信使核糖核酸(mRNA)作为一种极具潜力的新型手段崭露头角。然而,mRNA 自身存在易被降解、难以有效进入细胞内发挥作用等问题。合成脂质纳米颗粒(LNP)的出现为解决这些难题提供了有效的途径,其在 mRNA 递送方面展现出优势,成为当前研究的热点领域之一。
合成脂质纳米颗粒的组成结构
合成脂质纳米颗粒通常由可电离脂质、中性辅助脂质、胆固醇和聚乙二醇(PEG)修饰脂质等成分组成。可电离脂质在酸性环境(如内体中)带正电,可与带负电的 mRNA 结合形成复合物,有助于包裹和保护 mRNA;在生理 pH 条件下则呈电中性,降低了对生物体的有害性。中性辅助脂质如二油酰磷脂酰乙醇胺(DOPE)等能增强脂质双层的稳定性并促进膜融合。胆固醇有助于调节脂质膜的流动性和稳定性,而 PEG 修饰脂质则可提高纳米颗粒在体内中的循环时间,减少被免疫系统清除的几率,同时还能控制纳米颗粒的粒径大小和表面性质。
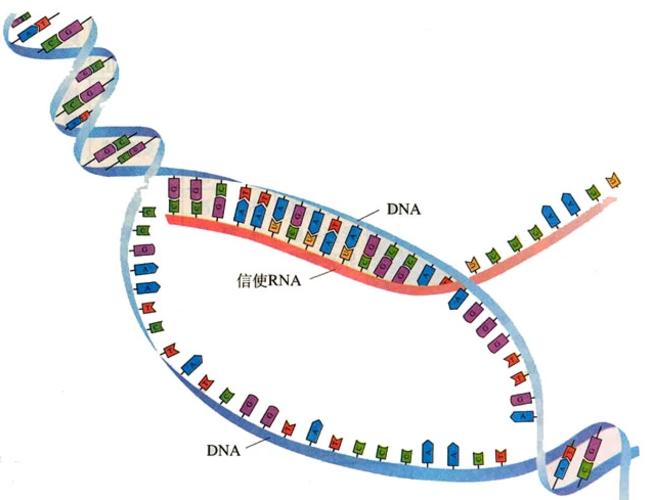
体内递送机制
在体内,合成脂质纳米颗粒通过与细胞表面的受体相互作用或内吞作用进入细胞。进入细胞后,纳米颗粒首先位于内体中。由于内体内部的酸性环境,可电离脂质带正电,引发内体膜的不稳定和破裂,从而将包裹的 mRNA 释放到细胞质中。释放后的 mRNA 可在细胞质中被核糖体识别并翻译表达相应的蛋白质,进而发挥其作用。例如在基因编辑、免疫等应用场景中,合成脂质纳米颗粒能够将编码特定功能蛋白或抗原的 mRNA 递送至靶细胞,实现对illness的干预。
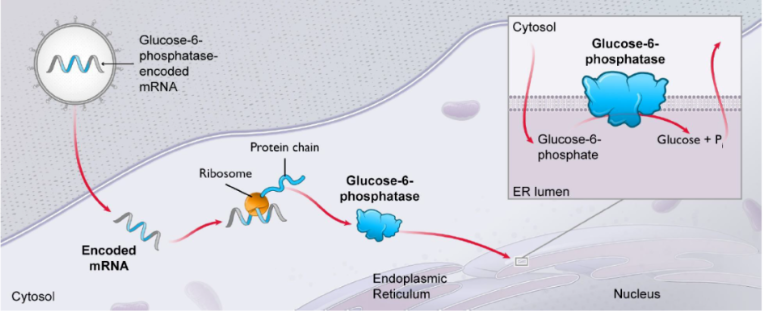
面临的挑战
尽管合成脂质纳米颗粒在 mRNA 递送方面取得了进展,但仍面临诸多挑战。首先,其在体内的分布还难以实现完全的准确控制,可能会在非靶组织或器官中积累,导致潜在的副作用。其次,不同个体对脂质纳米颗粒的反应存在差异,这可能与个体的遗传背景、生理状态等因素有关,从而影响效果的一致性。此外,大规模生产脂质纳米颗粒的成本较高,且质量控制标准仍有待进一步完善和统一,这在一定程度上限制了其商业化和应用的进程。

 2025-02-12 作者:ZJ 来源:
2025-02-12 作者:ZJ 来源:

