NHS-PEG113-PDPA 作为一种特殊的聚合物,由 N - 羟基琥珀酰亚胺(NHS)、聚合度为 113 的聚乙二醇(PEG113)以及聚(2-(二异丙基氨基)乙基甲基丙烯酸酯)(PDPA)组成,其对蛋白质结构与功能有着复杂且多面的影响。
从共价结合角度看,NHS 基团具有高反应活性,在生理条件下,能与蛋白质表面赖氨酸残基的伯胺(-NH₂)发生亲核取代反应,形成稳定酰胺键,实现 PEG113-PDPA 与蛋白质的连接。这一过程虽能为蛋白质带来新特性,但可能改变蛋白质局部电荷分布与空间位阻。例如,当多个 NHS-PEG113-PDPA 分子连接到蛋白质同一区域,电荷变化或空间拥挤可能干扰蛋白质原有二级结构(如 α- 螺旋、β- 折叠)的稳定性,影响其折叠状态,进而改变蛋白质整体构象。
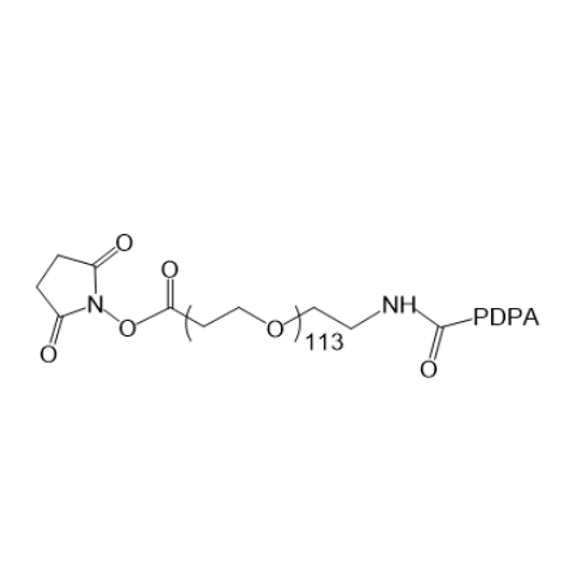
图为:NHS-PEG113-PDPA结构式
PEG113 长链凭借良好的生物相容性与亲水性,在修饰蛋白质时发挥重要作用。一方面,它能增加蛋白质水溶性,减少在生理环境中的聚集现象,提升蛋白质稳定性;另一方面,可通过空间位阻效应减少蛋白质与免疫细胞等的非特异性相互作用,降低免疫原性。不过,过长的 PEG113 链可能赋予蛋白质过大的柔性,使原本紧密有序的结构变得松散,影响蛋白质与底物、受体等分子的结合准确度,如某些酶与底物结合时,因 PEG113 链干扰,活性中心与底物契合度下降,催化效率降低。
PDPA 部分的环境响应性对蛋白质功能影响明显。其叔氨基在不同 pH 环境下电荷状态不同,pH 低于等电点(约 6.5)时,氨基质子化,PDPA 链段带正电,可通过静电作用与带负电生物分子(如核酸、带负电蛋白质区域)相互作用;pH 高于等电点时,PDPA 呈疏水性,可与疏水性生物分子区域发生疏水相互作用。这种特性可改变修饰后蛋白质在不同生理微环境中的分布与相互作用对象。在细胞内不同 pH 细胞器中,蛋白质可能因 PDPA 电荷或疏水性变化,改变在细胞器内定位,影响其参与的细胞代谢、信号传导等功能。
图为:聚乙二醇结构式
NHS-PEG113-PDPA 修饰蛋白质后,在蛋白质 - 蛋白质相互作用层面也有体现。修饰可能干扰蛋白质间原有相互作用界面,使蛋白质复合物形成受阻;也可能因引入新功能基团,创造新相互作用位点,诱导新蛋白质复合物形成。例如,PDPA 在特定 pH 下的电荷性质,可吸引原本不相互作用的蛋白质,改变细胞内蛋白质相互作用网络,影响细胞生理过程。

 2025-08-12 作者:lkr 来源:
2025-08-12 作者:lkr 来源:

