SA-N3 作为一种在生物研究领域崭露头角的化合物,其与蛋白质的相互作用机制备受关注。理解这一机制,有助于开发新型生物分析工具、药物递送系统以及深入解析生物过程。
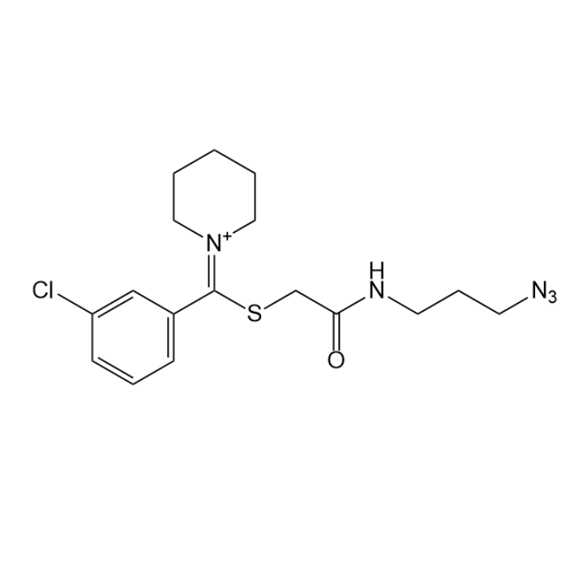
图为:SA-N3结构式
SA-N3 分子结构中,叠氮基团(-N3)是其参与特异性反应的关键部分。蛋白质由氨基酸残基组成,不同氨基酸残基侧链具有各异的化学性质,这为 SA-N3 与之相互作用提供了多样途径。从化学本质出发,SA-N3 与蛋白质可通过多种弱相互作用力发生结合。例如,范德华力普遍存在于分子间,SA-N3 与蛋白质表面原子因电子云波动产生瞬间偶极,进而形成范德华吸引力,尽管单个范德华力较弱,但众多范德华力的协同作用能使两者结合更稳定。
静电相互作用在 SA-N3 与蛋白质结合中也至关重要。蛋白质表面存在带正电(如赖氨酸、精氨酸残基)和带负电(如天冬氨酸、谷氨酸残基)的氨基酸,若 SA-N3 带有与之相反电荷,便能通过静电引力相互吸引。在生理 pH 条件下,某些蛋白质表面电荷分布特定,SA-N3 与之匹配的电荷区域结合,这种静电相互作用在一定程度上决定了两者结合的位点与强度。
图为:链霉亲和素结构式
除上述常规相互作用外,SA-N3 的叠氮基团可参与点击化学反应,为其与蛋白质相互作用增添独特方式。若蛋白质表面修饰有能与叠氮基团发生点击反应的官能团(如炔基),两者可通过高效、特异性的点击化学反应形成稳定共价键。这种共价连接相比弱相互作用更为牢固,在构建稳定生物偶联物方面具有优势。在药物研发中,可将携带Treatment 活性的 SA-N3 通过点击反应共价连接到靶向特定细胞表面蛋白的抗体上,实现药物准确递送至病变细胞。
研究 SA-N3 与蛋白质相互作用机制的方法多样。荧光光谱技术可利用 SA-N3 或蛋白质本身的荧光特性,或对其进行荧光标记,监测相互作用过程中荧光强度、波长等变化,以此推断结合模式与亲和力。等温滴定量热法能测量 SA-N3 与蛋白质结合过程中的热效应,直接获取结合反应的热力学参数,如结合常数、焓变和熵变等,从能量角度解析相互作用机制。此外,X 射线晶体学和核磁共振技术可提供 SA-N3 与蛋白质复合物的高分辨率三维结构信息,直观呈现两者结合位点及原子间相互作用细节。
总之,SA-N3 与蛋白质通过范德华力、静电相互作用等弱相互作用以及点击化学反应形成的共价连接发生相互作用,多种研究技术助力揭示这一复杂机制,为其在生物医学、生物分析等领域的应用奠定基础。

 2025-08-14 作者:lkr 来源:
2025-08-14 作者:lkr 来源:

