MPEG-STA(甲氧基聚乙二醇单硬脂酸酯)通过两亲性分子的界面自组装,实现对纳米材料表面亲疏水性的准确调控,其机制与分子构型、修饰密度及环境响应性密切相关。
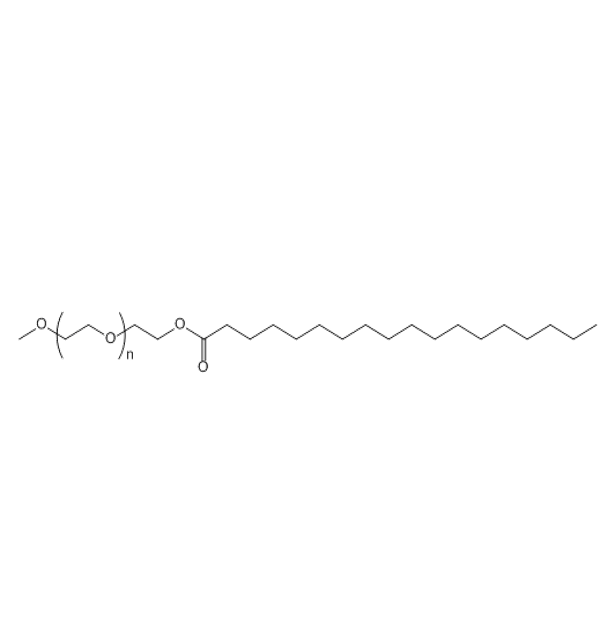
图为:MPEG-STA结构式
在调控原理上,MPEG-STA 的疏水端(硬脂酸链)通过范德华力或疏水相互作用锚定在疏水纳米材料表面(如 PLGA、碳纳米管),而亲水端(PEG 链)则向外伸展形成水化层。这种 “锚定-伸展” 构型使材料表面从疏水(水接触角>90°)转变为亲水(接触角<60°),核心在于 PEG 链与水分子的氢键作用及空间位阻效应。X 射线光电子能谱显示,修饰后纳米材料表面氧元素含量提升 30%-50%,证实亲水基团的富集。
调控效果受分子结构参数影响明显:PEG 链长增加(如从 2000 Da 增至 5000 Da)会增强表面亲水性,因更长的链段可形成更厚的水化层,接触角可降低 15°-20°;而硬脂酸链的疏水性增强或修饰密度过高时,可能导致分子堆叠,部分掩盖 PEG 的亲水作用,使亲水性提升受限。动态光散射测试表明,适度修饰(表面覆盖率 50%-70%)可使纳米颗粒的水合粒径增加 10-20 nm,印证 PEG 链的伸展状态。
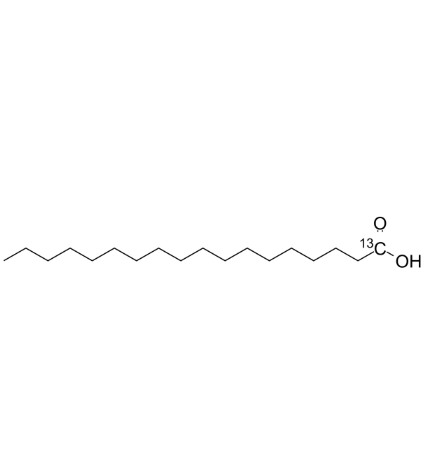
图为:STA结构式
环境响应性进一步拓展了调控维度。在低温或极性溶剂中,PEG 链呈舒展状态,亲水性占优;而在高温或非极性环境中,链段收缩,疏水基团暴露,接触角可回升 20°-30°。这种可逆调控机制使纳米材料能适应复杂生物微环境,例如在血液中保持亲水以减少蛋白吸附,在细胞内疏水微环境中促进药物释放。
该调控机制为纳米载体的界面设计提供了普适性策略,通过优化 MPEG-STA 的修饰参数,可按需定制材料表面亲疏水性,平衡其在循环稳定性与细胞摄取效率间的矛盾,推动纳米药物的临床转化。

 2025-08-18 作者:lkr 来源:
2025-08-18 作者:lkr 来源:

