RB-PEG600-BIOTIN(罗丹明-聚乙二醇 600-生物素)凭借生物素与链霉亲和素的高特异性结合及罗丹明的荧光示踪能力,为蛋白质纯化提供了高效且可视化的解决方案。
该方法的核心原理是基于生物素-链霉亲和素系统的强相互作用。首先需对目标蛋白质进行生物素化修饰:通过化学偶联或基因工程手段,将生物素标记于目标蛋白的特定位点(如赖氨酸残基)。修饰后的蛋白质可与 RB-PEG600-BIOTIN 中的生物素形成竞争结合,但因 RB-PEG600-BIOTIN 的空间位阻效应,其结合力弱于目标蛋白与链霉亲和素的相互作用。
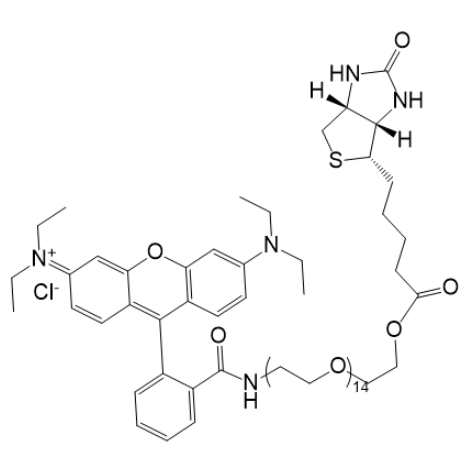
图为:RB-PEG600-BIOTIN结构式
具体操作步骤如下:第一步,将链霉亲和素包被的磁珠或层析树脂与含有生物素化目标蛋白的粗提液孵育(4℃,1-2 小时),使目标蛋白通过生物素-链霉亲和素作用被特异性捕获。第二步,加入过量 RB-PEG600-BIOTIN 溶液(浓度为目标蛋白的 10-20 倍),在室温下温和振荡 30 分钟,利用竞争性结合将目标蛋白从载体上洗脱。此时,洗脱液中包含目标蛋白与 RB-PEG600-BIOTIN 的混合体系。第三步,通过凝胶过滤层析分离二者:由于 PEG600 链段增加了 RB-PEG600-BIOTIN 的流体力学体积,其出峰时间早于目标蛋白,可实现高效分离。
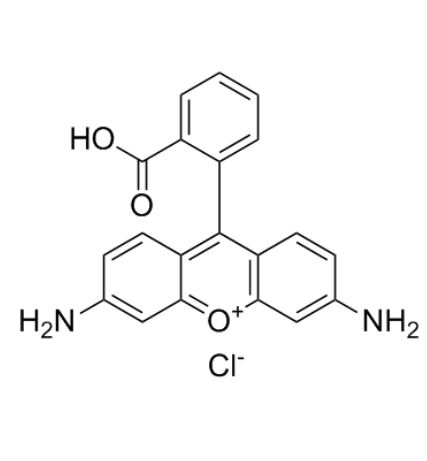
图为:RB结构式
该方法的优势在于:罗丹明基团的荧光特性(激发 544nm / 发射 576nm)可实时监测洗脱效率,通过荧光强度定量评估目标蛋白纯度;PEG600 的亲水性减少了蛋白质的非特异性吸附,提高纯化效率;生物素-链霉亲和素的高亲和力(结合常数 10¹⁵ M⁻¹)确保了纯化的高特异性,纯度可达 95% 以上。此方法尤其适用于低丰度重组蛋白的纯化,为蛋白质组学研究提供了可靠的技术支持。

 2025-08-20 作者:lkr 来源:
2025-08-20 作者:lkr 来源:

