ROS响应型脂质体微气泡的构建需整合脂质体与微气泡特性,利用ROS敏感化学键实现药物在氧化应激环境中的释放,以下从设计思路、材料选择、构建方法、功能验证、应用拓展几个方面展开分析:
设计思路
ROS响应型脂质体微气泡的构建需融合脂质体与微气泡的优势,并引入ROS敏感化学键。脂质体可包裹药物,微气泡提供超声成像或增强药物递送功能,ROS敏感键(如TK键、硒键等)能在氧化应激环境中断裂,触发药物释放。
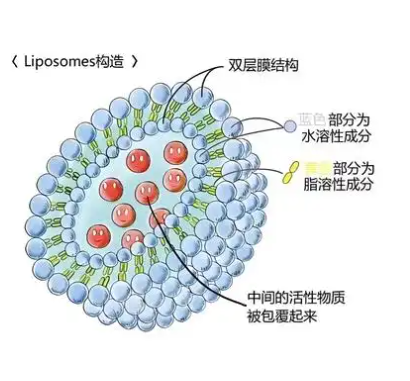
材料选择
1.脂质体成分:磷脂是构成脂质体双分子层的基本成分,常见的有卵磷脂(PC)等,为脂质体提供基本的结构框架和生物相容性。此外,还可加入胆固醇调节脂质体膜的流动性和稳定性。
2.ROS响应性成分:可选择含有硫醚键、二硫键、TK键、硒键等可被ROS氧化的化学键的脂质或聚合物,如DSPE-TK-PEG等。其中,DSPE是磷脂部分,提供疏水性;TK是可被ROS切割的硫醚键连接的链段;PEG是聚乙二醇链段,可增加脂质体的稳定性和水溶性。
3.微气泡成分:通常采用气体(如空气、六氟化硫等)和表面活性剂或脂质材料形成稳定的气泡结构。
4.辅助成分:可添加一些功能性分子,如靶向配体(如叶酸靶向受体、apoE模拟肽等,可实现对特定细胞或组织的靶向递送)、荧光标记物(如ICG等,可用于体内成像,监测脂质体的分布和效果)等。
构建方法
1.薄膜分散法:先采用薄膜分散法制备普通脂质体,然后通过化学反应将ROS响应性基团或分子修饰到脂质体表面或嵌入脂质双分子层中。例如,将含有ROS响应性基团的磷脂与其他普通磷脂一起溶解在有机溶剂中,旋转蒸发成膜后水化形成脂质体,使ROS响应性磷脂均匀分布在脂质体膜中。
2.自组装法:利用具有ROS响应性的两亲性分子在水溶液中自组装形成脂质体。这些两亲性分子在ROS存在时,其分子间的相互作用会发生改变,从而影响自组装过程和形成的脂质体结构。例如,一些含有二硫键的两亲性聚合物在ROS作用下,二硫键断裂,聚合物的亲水性和疏水性发生变化,导致脂质体的形态和性质改变。
3.微气泡制备与融合:采用合适的方法制备微气泡,如通过声振法、机械搅拌法等使气体分散在含有表面活性剂或脂质材料的溶液中形成微气泡。然后将制备好的ROS响应型脂质体与微气泡进行融合,可通过物理方法(如超声处理、挤压等)或化学方法(如利用脂质体与微气泡表面成分的相互作用)促进两者的融合。
4.逆相蒸发法:将脂质材料溶解在挥发性有机溶剂中形成饱和溶液,转移到圆底烧瓶中,使用旋转蒸发仪缓慢蒸发有机溶剂,形成脂质膜,最后将其转移到水相中形成脂质体。
5.溶剂注入法:将溶解于有机溶剂中的磷脂和胆固醇等膜材料注入磷酸缓冲溶液中,搅拌至有机溶剂除尽,形成脂质体。
功能验证
1.ROS响应性验证:将构建好的ROS响应型脂质体微气泡置于不同浓度的ROS环境中,通过检测药物释放情况、脂质体或微气泡结构变化(如粒径变化、形态改变等)来验证其ROS响应性。例如,利用透析法或离心法分离释放出的药物,并用高效液相色谱等方法测定药物释放量;利用动态光散射仪测定粒径变化,用透射电镜观察形态改变。
2.成像功能验证:若脂质体微气泡中添加了荧光标记物或具有超声造影功能,可通过体内外成像实验验证其成像效果。例如,将标记有荧光物质的脂质体微气泡注射到动物体内,利用小动物活体成像系统观察其在体内的分布和荧光信号强度;利用超声成像设备观察微气泡的超声造影效果。
3.靶向性验证:若脂质体微气泡表面修饰了靶向配体,可通过体外细胞实验和体内动物实验验证其靶向性。在体外细胞实验中,将靶向脂质体微气泡与目标细胞共同孵育,观察细胞对脂质体微气泡的摄取情况。

瑞禧生物定制的相关产品:
1.mPEG-TK脂质体的构建
结构组成
mPEG-TK脂质体由甲氧基聚乙二醇(mPEG)和酮缩硫醇(TK)键组成,mPEG提供良好的水溶性和生物相容性,TK键则赋予脂质体ROS响应性。
构建方法
通常采用薄膜分散法或逆相蒸发法。以薄膜分散法为例,先将mPEG-TK等脂质材料溶解在有机溶剂中形成薄膜,再将其置于水相中,通过搅拌或超声处理形成脂质体。
2.MPEG-TK-PCL纳米粒子的构建
结构组成
由亲水性的mPEG和疏水性的聚己内酯(PCL)通过ROS响应的TK键连接而成。这种结构使得纳米粒子在ROS高表达的环境中能够快速响应并释放药物。
构建方法
通过开环聚合法制备mPEG-PCL两嵌段高分子,在聚合过程中引入TK键。具体步骤包括将mPEG和PCL通过化学反应连接,并在反应过程中嵌入TK键,形成具有ROS响应性的聚合物。
功能特点
药物释放:在ROS作用下,TK键断裂,导致纳米粒子结构解体,从而实现药物的快速释放。

 2025-04-29 作者:wff 来源:
2025-04-29 作者:wff 来源:

