蛋白质化合物具有高度特异性和高效性,但也面临着稳定性差、体内半衰期短等问题。单官能团聚乙二醇修饰作为一种有效的策略,能够改善蛋白质化合物的理化性质和药代动力学特性,同时对其生物活性的保护也重要。
单官能团聚乙二醇对蛋白质化合物的修饰策略
修饰位点选择:蛋白质化合物含有多个可修饰的氨基酸残基,如氨基、羧基、巯基等。选择合适的修饰位点对于保留蛋白质活性和实现预期修饰效果至关重要。通常,优先选择远离活性中心的位点进行修饰,以减少对蛋白质功能的直接影响。例如,对于一些酶类蛋白质,可选择其表面的赖氨酸残基的氨基进行修饰,通过控制反应条件和试剂比例,实现单官能团聚乙二醇的定点连接。
图:化合物蛋白模型
修饰反应类型:常见的修饰反应包括酰化反应、烷基化反应等。以酰化反应为例,单官能团聚乙二醇的末端活化基团(如琥珀酰亚胺酯等)可与蛋白质上的氨基反应形成酰胺键。在反应过程中,需要准确控制反应温度、pH 值和反应时间等参数,以确保修饰反应的高效性和选择性。同时,为了避免过度修饰导致蛋白质活性丧失,通常采用低摩尔比的单官能团聚乙二醇与蛋白质进行反应,并结合分离纯化技术,去除未反应的试剂和副产物。
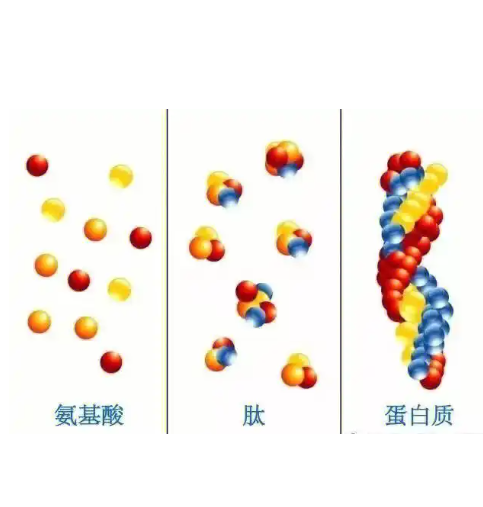
活性保护效果:稳定性提高:单官能团聚乙二醇修饰后,蛋白质化合物的稳定性得到增强。聚乙二醇链的空间位阻效应可以减少蛋白质分子间的相互作用,降低蛋白质的聚集倾向。此外,修饰后的蛋白质化合物对酶解的抵抗力也有所增加,延长了其在体内外的保存时间。
活性保留:尽管进行了化学修饰,但通过合理的修饰策略,蛋白质化合物的生物活性能够得到较好的保留。在适当的修饰条件下,蛋白质化合物的催化活性、受体结合能力等关键生物功能仅受到轻微影响。

 2025-04-29 作者:ZJ 来源:
2025-04-29 作者:ZJ 来源:

