微米脂质体,又称巨型单层囊泡(GUV),由单个脂质双层组成。微米脂质体是多功能且有前途的细胞大小的生物膜模拟平台。微米脂质体可以直接在显微镜下观察。微米脂质体与纳米脂质体在尺寸、特性及应用场景上存在差异,以下从核心参数、功能优势及技术挑战三方面展开对比分析:
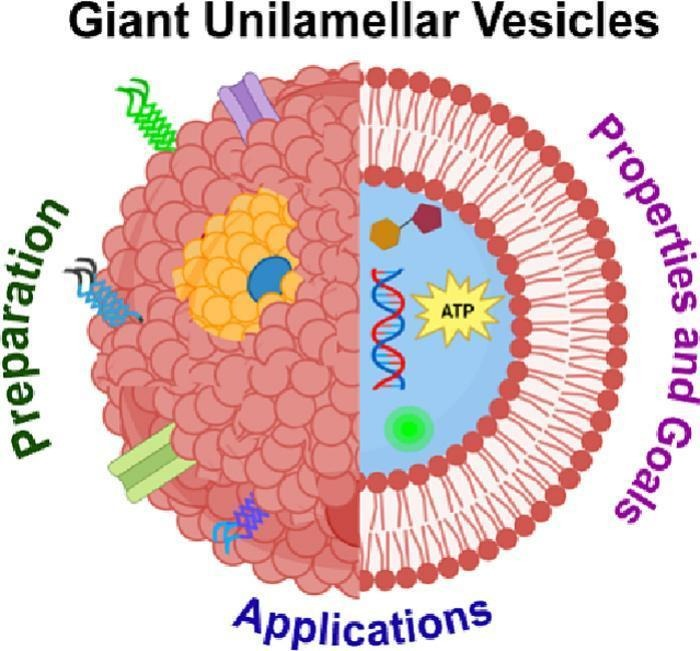
一、尺寸对比
微米脂质体(GUVs)
直径范围为1-100 μm,与真核细胞(10-30 μm)尺寸相当,可构建细胞级仿生体系。其膜厚度约4-5 nm,单囊泡容积达皮升级(10⁻¹² L),支持多组分生物分子共封装。
纳米脂质体(NLVs)
粒径集中在20-200 nm,部分产品如阿米卡星脂质体吸入混悬液(Arikaye)粒径为200-300 nm(仍属纳米级)。纳米尺度赋予其强组织穿透性。
二、特性对比
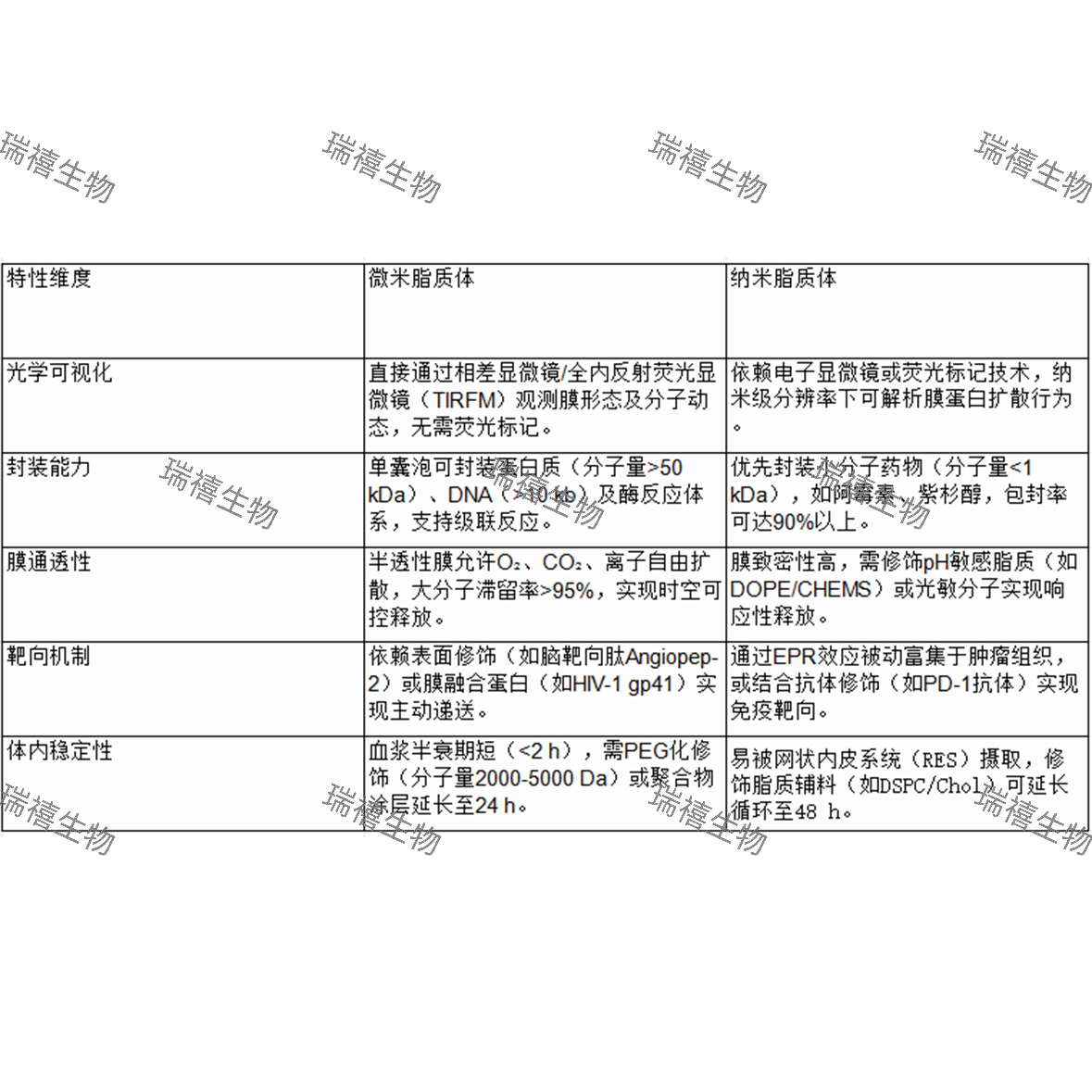
三、应用场景对比
微米脂质体
构建人工线粒体(封装三羧酸循环酶)及基因表达系统(共封装T7 RNA聚合酶与DNA模板)。
解析膜蛋白相互作用(如EGF受体二聚化动力学常数k_on=1.2×10⁶ M⁻¹s⁻¹)及相分离机制。
封装CRISPR/Cas9质粒与药物(如紫杉醇)。
纳米脂质体
阿霉素脂质体(Doxil)通过EPR效应富集于特定组织。
mRNA疫苗(如辉瑞/BioNTech的BNT162b2)采用LNP(脂质纳米颗粒)技术,实现胞内递送。
四、技术挑战对比
微米脂质体
制备瓶颈:传统电形成法产量仅10⁵个/cm²,微流控芯片(阶梯乳化法)可提升至10⁹个/h,但需解决脂质纯度(>99.5%)与批次间均一性(CV<5%)。
临床转化:动物模型中富集率(3.5% ID/g)低于纳米脂质体(>8% ID/g),需结合主动靶向与被动靶向策略提升富集率至6.8% ID/g。
纳米脂质体
制备瓶颈:薄膜水化法易产生多室脂质体,反相蒸发法需优化有机溶剂残留(<0.1%)。
临床转化:纳米载体易被RES摄取,需修饰“隐形”脂质(如DSPE-PEG2000)降低非特异性吸附,但可能影响靶向效率。
微米脂质体和纳米脂质体各有优势,选择使用哪种脂质体取决于具体的应用需求。纳米脂质体在全身给药、基因递送方面表现出色,而微米脂质体则更适合局部给药和高药物载量的应用。

 2025-05-06 作者:wff 来源:
2025-05-06 作者:wff 来源:

