纳米金标记免疫电镜技术通过将纳米金颗粒(AuNPs)与特异性抗体共价偶联,构建出兼具高电子密度与分子识别能力的“纳米探针”,实现了对抗原分子在纳米尺度上的定位与可视化追踪。该技术不仅继承了传统免疫电镜的高分辨率优势(分辨率可达0.2-0.5 nm),更凭借纳米金物理化学特性,开创了多靶点、动态化、定量化的新一代电镜成像模式。
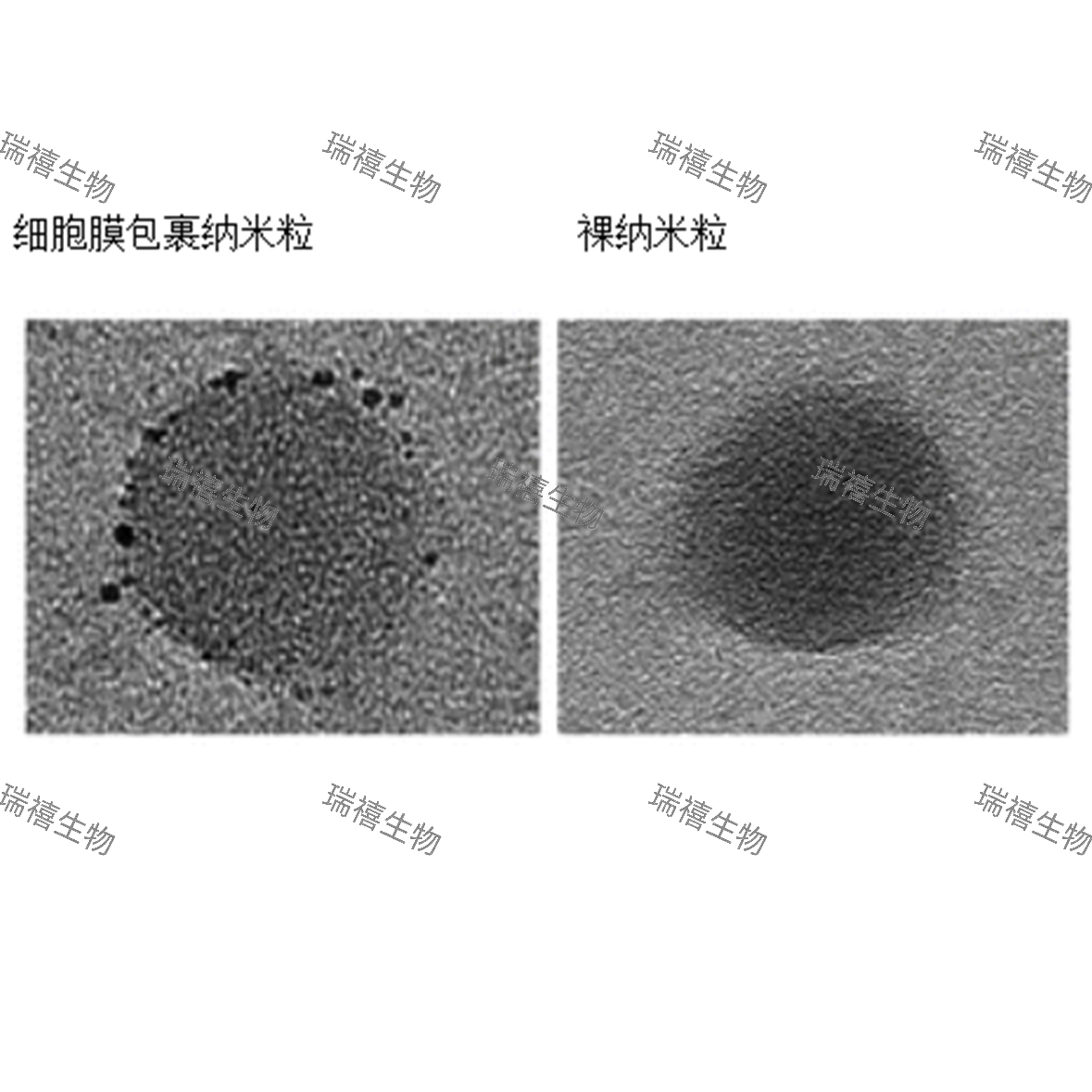
一、纳米金颗粒作为标记物的核心优势:
超强电子密度信号:金原子序数(Z=79)赋予纳米金远超生物大分子的电子散射能力,在透射电镜(TEM)下呈现为高对比度、圆整规则的黑色颗粒(直径5-100 nm可调),其信号强度是传统铁蛋白标记物的100倍以上,即使单颗粒也可在复杂生物背景中清晰分辨。
亚细胞级定位精度:纳米金-抗体复合物通过抗原-抗体特异性结合锚定于靶分子,其定位误差<5 nm,可指示膜蛋白、核内复合体等亚细胞结构的空间分布。例如,在突触囊泡研究中,通过5 nm纳米金标记突触前膜蛋白,成功解析了囊泡释放位点与钙离子通道的纳米级空间关系。
多形态兼容性:颗粒尺寸(5-100 nm)与表面修饰(如巯基、羧基、链霉亲和素)的灵活调控,使其可适配不同实验需求:
小颗粒(5-15 nm):用于高密度标记,解析蛋白质复合物内部亚基分布;
中颗粒(20-40 nm):平衡标记密度与信号强度,适用于囊泡等中等尺寸靶标;
大颗粒(60-100 nm):作为“信号放大器”,用于低丰度靶标检测或超分辨成像。
二、纳米金颗粒双重/多重标记
尺寸差异编码:通过组合不同直径的纳米金颗粒(如5 nm标记A抗原、15 nm标记B抗原),可在单次电镜观察中实现两种以上靶标的并行检测。例如,在研究细胞自噬通路时,利用5 nm纳米金标记LC3蛋白、20 nm纳米金标记p62蛋白,直观呈现自噬体形成过程中两种蛋白的共定位动态。
金-银增强技术:对已标记的纳米金颗粒进行银离子沉积,将颗粒尺寸放大3-5倍,形成“核-壳”结构复合探针。该技术不仅可提升低丰度靶标的信号强度,更可通过控制银沉积时间(5-30分钟)实现灰度梯度标记,为多靶点区分提供新维度。
能量过滤成像(EF-TEM):结合能量选择狭缝,利用不同尺寸纳米金颗粒的等离子体共振峰差异(5 nm:520 nm;20 nm:530 nm),实现颜色编码的多色成像。在神经突触研究中,通过5 nm(红色)、15 nm(绿色)、30 nm(蓝色)纳米金的三重标记,首次在电镜下解析了突触前膜三种不同类型囊泡的分子组成与空间排列。
三、纳米金颗粒技术突破
超薄切片免疫标记:
预嵌入标记:在树脂包埋前对细胞或组织进行纳米金标记,经超薄切片(50-70 nm)后直接观察,最大限度保留抗原表位,适用于易失活靶标(如磷酸化蛋白)的检测。
后嵌入标记:对已包埋的切片进行纳米金标记,结合低温冷冻蚀刻技术,可穿透树脂屏障标记深层结构。
冷冻电镜单颗粒分析(Cryo-EM SPA):
动态过程捕捉:通过时间分辨冷冻电镜技术,结合不同时间点纳米金标记的密度变化,首次观察到囊泡运输过程中SNARE蛋白复合物的组装-解聚动态。
原位标记与活体成像:
光-电联用技术:开发近红外二区(NIR-II)响应的纳米金探针(如Au@Ag核壳结构),先通过光声成像(PAI)定位活体动物tumor区域,再取材进行电镜纳米金标记,实现“宏观-微观”成像的无缝衔接;
超分辨电镜(SR-EM):将纳米金标记与光致定位显微术(PALM)结合,通过单颗粒追踪算法,在20 nm分辨率下解析了线粒体内膜转运蛋白的动态扩散轨迹。

 2025-05-07 作者:wff 来源:
2025-05-07 作者:wff 来源:

