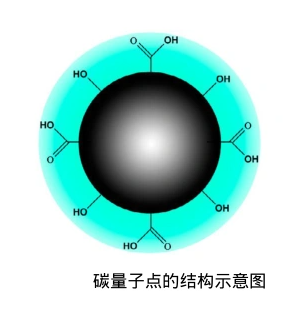
碳量子点(Carbon Quantum Dots, CQDs)因其光学性质、良好的生物相容性以及可调节的荧光特性,在生物医学领域尤其是药物递送系统中展现出了应用潜力。本文将详细探讨碳量子点作为药物载体的靶向性与可控释放机制。
1. 碳量子点的靶向性设计
1.1 生物分子修饰
靶向配体的引入:通过在碳量子点表面修饰特定的生物分子(如抗体、肽段、小分子配体等),可以实现对特定细胞或组织的靶向。
多肽和抗体修饰:除了叶酸,还可以使用其他生物分子进行修饰。
糖类分子修饰:某些糖类分子(如甘露糖、岩藻糖等)能够被特定的糖受体识别。通过在碳量子点表面修饰这些糖类分子,可以实现对特定细胞类型的靶向递送,1.2 靶向机制
受体介导的内吞作用:修饰有靶向配体的碳量子点可以通过受体介导的内吞作用进入细胞。
细胞特异性识别:通过选择特定的靶向配体,可以实现对特定细胞类型的特异性识别。
2. 碳量子点的可控释放机制
2.1 刺激响应性设计
pH响应性释放:tumor微环境通常呈酸性(pH值约为6.5-6.8),而正常组织的pH值约为7.4。通过在碳量子点表面修饰pH响应性官能团(如腙键、亚胺键等),可以实现药物在tumor微环境中的特异性释放。
温度响应性释放:通过在碳量子点表面修饰温度响应性聚合物(如聚N-异丙基丙烯酰胺,PNIPAM),可以实现药物在特定温度下的释放。
氧化还原响应性释放:细胞内的氧化还原环境与细胞外环境不同。通过在碳量子点表面修饰氧化还原响应性官能团(如二硫键),可以实现药物在细胞内的特异性释放。
2.2 释放机制
化学键断裂:通过设计特定的化学键(如酯键、酰胺键等),可以在特定条件下断裂,从而释放负载的药物。
物理刺激响应:除了化学刺激,还可以通过物理刺激(如光、磁场等)实现药物的可控释放。

 2025-05-15 作者:wff 来源:
2025-05-15 作者:wff 来源:

