脂质囊泡:由脂质分子自组装形成的封闭囊状结构,它涵盖多种脂质基载体系统,包括脂质体、脂质纳米粒和脂质微泡。它们在生物医学领域(如药物递送、成像等)具有应用。
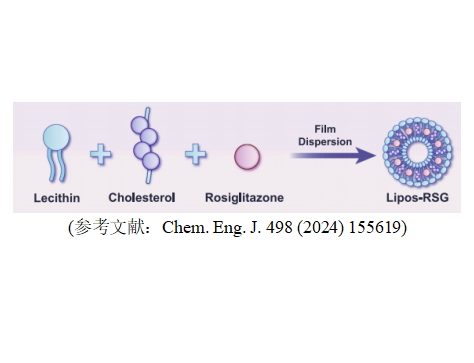
1. 脂质体(Liposomes)
成分:以天然或合成磷脂为主(如卵磷脂),常添加胆固醇以增强膜稳定性。
结构:由磷脂双层(类似细胞膜)形成的封闭囊泡,内部为水相核心,可包裹亲水性药物;磷脂层内可嵌入疏水性药物。
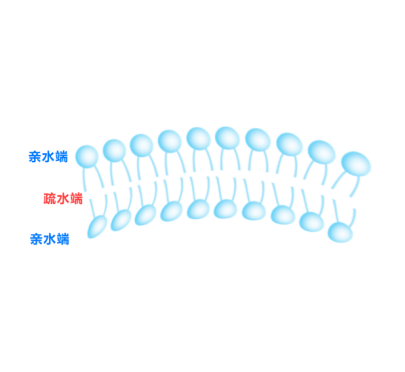
尺寸范围:25 nm-1μm。
特点:
① 生物相容性高,可延长药物循环时间(通过表面修饰如PEG化)。
② 被动靶向(如通过EPR效应富集在tumor组织)。
应用:
小分子药物递送(如阿霉素脂质体)。
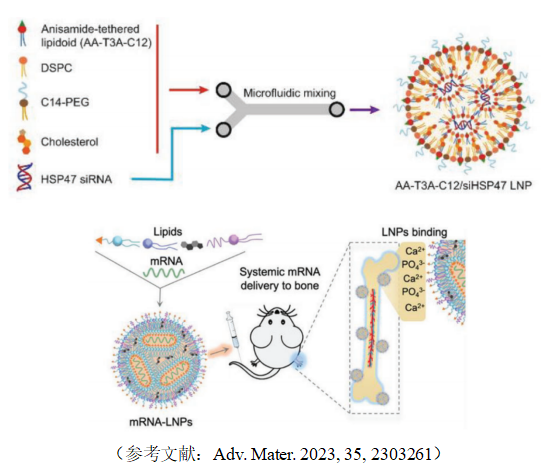
2. 脂质纳米粒(Lipid Nanoparticles——LNPs)
成分:
由混合脂质(磷脂、胆固醇、阳离子脂质、PEG脂质等)构成;其中,阳离子脂质是关键组分(如可离子化脂质DLin-MC3-DMA、永久阳离子脂质DOTAP),用于核酸包封和细胞内释放。
结构:
多为固态或液晶态脂质核心(如甘油三酯)包裹药物,外层覆盖磷脂层(可能含功能性脂质如PEG脂质)。

尺寸范围:20-200 nm。
特点:
① 高载药效率(尤其适合核酸药物如siRNA、mRNA)。
② 稳定性优于脂质体。
应用:
mRNA疫苗、基因编辑工具(CRISPR)、小分子药物靶向递送。
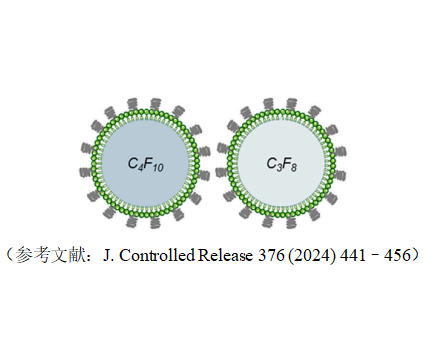
3. 脂质微泡(Lipid Microbubbles)
成分:由磷脂(如DPPC)和表面活性剂(如聚乙二醇)构成,气体为核心成分。
结构:气体核心(如全氟化碳)被脂质单层或双层包裹,形成微米级囊泡。
尺寸范围:1-10 μm。
特点:
① 对超声敏感:微泡在超声波下振动或破裂,能够增强成像对比度或促进药物释放。
② 缩短体内循环时间(几分钟至几小时)。
应用:
超声成像:作为造影剂增强Blood vessels或组织显影。
超声靶向Treatment :通过超声触发微泡破裂,局部释放药物。
三者的核心区别
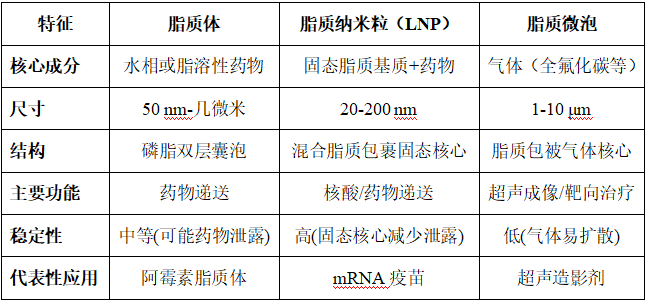
根据用途进行载体选择:
递送药物、小分子、蛋白:优先选择脂质体。
递送核酸(mRNA/siRNA):必须使用LNP(依赖离子化脂质包封)。
成像或超声辅助Treatment :选择脂质微泡。

 2025-05-22 作者:wff 来源:
2025-05-22 作者:wff 来源:

