一. 产品简介
脂质纳米粒(Lipid nanoparticles,LNPs)转染试剂盒适用于将 DNA 或 RNA 分子(如 siRNA、mRNA、shRNA 等),亦可适用于活体动物的核酸转染以达到目的。其配方优化了转染效率,同时降低了细胞Poison 性,适用于多种细胞类型,包括贴壁细胞和悬浮细胞,为基因转染实验提供性能和可靠的结果。试剂盒内试剂均为无菌形式提供,无需额外灭菌处理,避免了使用过程中核酸酶解,制备得到的 LNP 转染试剂可直接应用于生物实验研究。本试剂盒提供两种灵活制备方式,既可通过移液器手动混合实现 LNPs 的快速小规模制备,也可配合微流控设备进行稳定、均一的大批量生产。
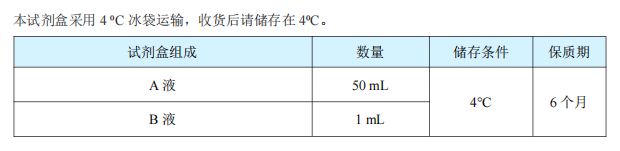
二. 试剂盒组成与存储
三. 操作说明
1. 细胞培养
1) 贴壁细胞:以 24 孔板为例(其它培养板或培养皿可参考 24 孔板):在转染前一天(18-24 小时)按照每孔约 10-20 万细胞(具体的细胞数量据细胞类型、大小和细胞生长速度等而定)接种到 24 孔板内进行培养,使第二天细胞密度能达到约 60-80%。
2) 悬浮细胞:在即将制备复合物之前,用不含抗生素的培养基接种适量细胞。
实验前请确保:
细胞活力良好,处于对数生长期。
培养基:转染前更换为无血清、无抗生素培养基。
DNA或RNA要求:核酸为冻干粉或溶液均可;核酸为溶液时浓度需≥0.125μg/μL。DNA纯度(A260/A280处于 1.8~2.0 之间);RNA 无 RNase 污染。
2. 手动法制备 LNPs 和转染细胞
按照下表手动制备 LNPs 并转染细胞:
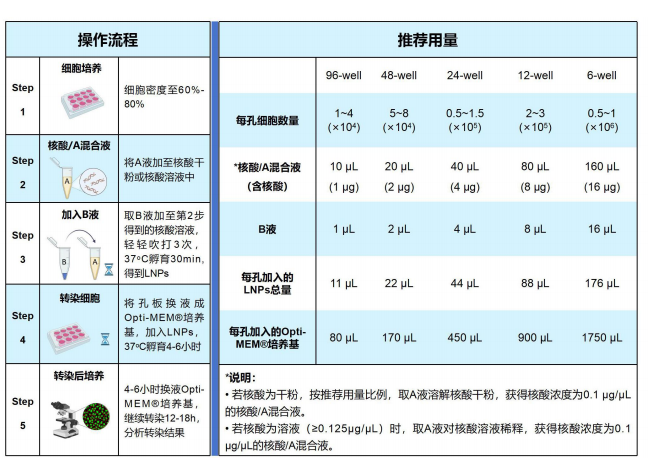
代表性案例 1(核酸为干粉,以单个培养孔用量为例)
按上表步骤,为得到 10 μL 的 0.1 μg/mL 核酸/A 混合液,须向 1 μg 核酸中加入 10 μL A 液溶解,得到10 μL 的核酸/A 混合液(核酸浓度为 0.1μg/mL)。向混合液中加入 1 μL 的 B 液后,轻轻吹打 3 次,37 ℃孵育 30 min 得到 11 μL 的 LNPs。将培养孔内培养基换成 80 μL 的 Opti-MEM®培养基,加入 11 μL 的 LNPs后 37 oC 孵育 4-6 小时。之后,再将培养孔内培养液换成 Opti-MEM®培养基,继续培养 12-18h 即完成转染。
代表性案例 2(核酸为 0.125 μg/mL 溶液,以单个培养孔用量为例)
按上表步骤,为得到 10 μL 的 0.1 μg/mL 核酸/A 混合液,须向 8 μL 核酸溶液(0.125μg/mL)中加入 2 μL A 液进行稀释,得到 10 μL 的核酸/A 混合液(核酸浓度为 0.1μg/mL)。向混合液中加入 1 μL 的 B 液后,轻 轻吹打 3 次,37 oC 孵育 30 min 得到 11 μL 的 LNPs。将培养孔内培养基换成 80 μL 的 Opti-MEM®培养基, 加入 11 μL 的 LNPs 后 37 oC 孵育 4-6 小时。之后,再将培养孔内培养液换成 Opti-MEM®培养基,继续培养 12-18h 即完成转染。
代表性案例 3(核酸为 1 μg/mL 溶液,以单个培养孔用量为例)
按上表步骤,为得到 10 μL 的 0.1 μg/mL 核酸/A 混合液,须向 1 μL 核酸溶液(1 μg/mL)中加入 9 μL A 液进行稀释,得到 10 μL 的核酸/A 混合液(核酸浓度为 0.1μg/mL)。向混合液中加入 1 μL 的 B 液后,轻轻吹打 3 次,37 oC 孵育 30 min 得到 11 μL 的 LNPs。将培养孔内培养基换成 80 μL 的 Opti-MEM®培养基,加入 11 μL 的 LNPs 后 37 oC 孵育 4-6 小时。之后,再将培养孔内培养液换成 Opti-MEM®培养基,继续培养 12-18h 即完成转染。
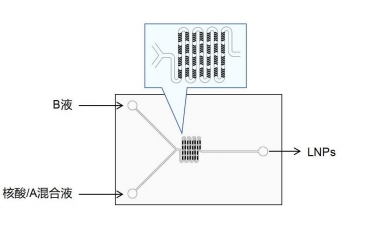
3. 微流控法制备 LNPs
使用微流控芯片代替手动制备 LNPs 时,请采用鱼骨芯片(芯片结构如下图)。在完成 Step 2 之后,将核酸/A 混合液与 B 液分别连接至微流控两根进样管道,控制核酸/A 混合液:B 液进样流速比为 10:1,总流速≥0.1 mL/min。本试剂盒配方已经过优化,得到的 LNPs 无需透析和超滤等纯化步骤。按照前面同样的操作流程进行细胞转染。
四. 注意事项
建议在无菌条件下操作,避免引入外源核酸酶导致核酸降解失活。
B 液保存在 4℃干燥环境,使用前平衡至室温,使用过程中需避免长时间敞口,使用后需要密封好保存。
由于 B 液含乙醇,制备得到的 LNPs 原液中乙醇含量<10%,经培养基稀释后乙醇含量降低至<1%。因 此,本试剂盒制备得到的 LNPs 可以不需要纯化处理直接使用,少量乙醇并不会明显影响细胞生长。若 需要去除乙醇,可通过超滤(步骤如下)或者透析去除。
超滤步骤:向产物溶液添加 4 倍体积的 A 液进行稀释,置于 3 kD 超滤管中,3000-5000 g 离心 10-15 min, 浓缩至原体积的 1/4。向超滤管中添加 pH=7.4 的无酶 PBS 或 Tris-HCl (10 mM)再次超滤,浓缩至原 体积 1/4,重复该步骤 2-3 次,使乙醇含量降低至 0.5%。最后将溶液储存在 4℃,可保存 2-3 周。请勿将产物储存在-20℃或-80℃!
核酸/A 混合液:B 液约为 10 : 1(体积比)。当核酸分子量较大时,可能会影响 LNPs 转染试剂稳定性,此时可增加 B 液用量,使得核酸/A 混合液:B 液为 10 : 2(体积比)。
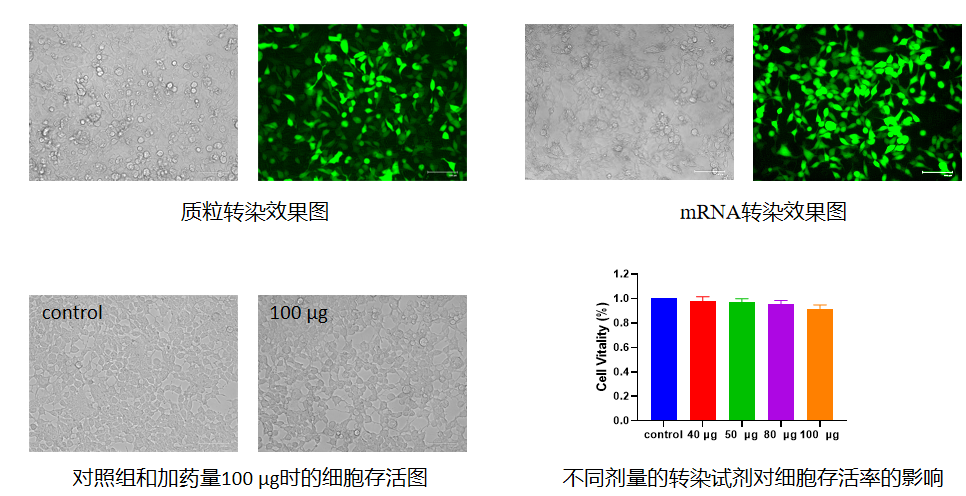
对于某些半衰期比较长的目的基因需要在转染后 3-5 天,才能检测到 RNA 或蛋白水平的下降。因细胞类型不同和培养条件差异,最佳的转染条件(试剂用量、转染时间等)会存在差异,可以在上述推荐用量基础上再优化用量,以获得最佳转染条件。 Ø
以 24 孔板为例 293T 细胞转染 24h 的效果图:

 2025-06-26 作者:wff 来源:
2025-06-26 作者:wff 来源:

