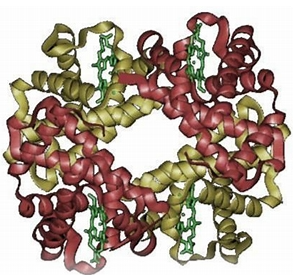
转铁蛋白的结构特点
1、单链糖蛋白结构:转铁蛋白是分子量约为 7.7 万的单链糖蛋白,含糖量约为 6%4。糖基化对于转铁蛋白的结构稳定性和功能发挥具有重要作用,能够帮助其在血浆环境中保持正确的构象,以便有效地结合和转运铁离子。
2、两个同源结构域:转铁蛋白包含两个高度同源的结构域,每个结构域又由两个小亚基构成。这种结构使得转铁蛋白整体呈现出一种对称的形态,两个结构域的存在为铁离子的结合提供了特定的空间结构基础。小亚基间的间隙是铁离子的结合位点,这种结构设计使得转铁蛋白能够特异性地结合铁离子,并且保证了结合的稳定性和可逆性。
3、多个氨基酸残基的作用:转铁蛋白由 679 个氨基酸残基组成,其中一些氨基酸残基在铁离子的结合和转运过程中发挥着关键作用。例如,组氨酸、天冬氨酸等氨基酸残基可以通过与铁离子形成配位键,从而将铁离子牢固地结合在转铁蛋白分子上9。同时,这些氨基酸残基的排列和空间位置也决定了转铁蛋白对铁离子的亲和力和选择性。
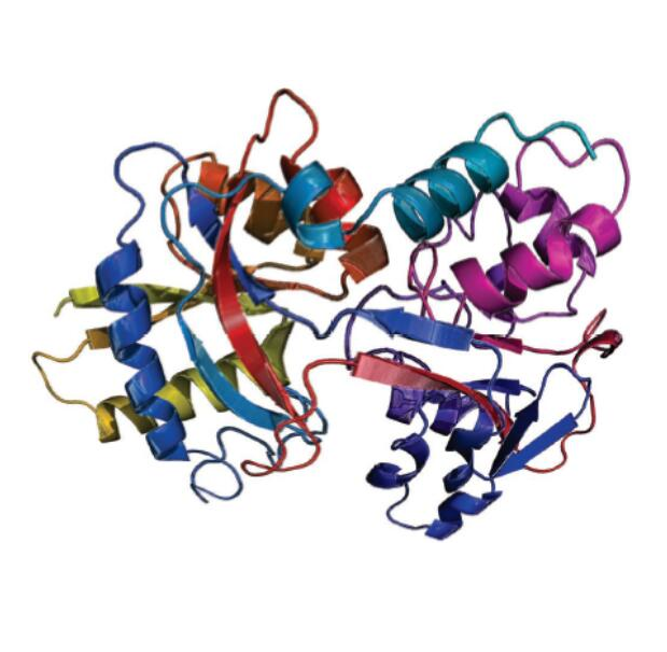
对铁转运功能的影响
1、高亲和力结合铁离子:转铁蛋白对铁离子具有很高的亲和力,能够在生理条件下与铁离子紧密结合。每个转铁蛋白分子可以可逆地结合两个三价铁原子,铁原子稳定常数分别约为 1030 和 10279。这种高亲和力的结合确保了转铁蛋白能够有效地将铁离子从肠道吸收部位、储铁组织等地方运输到骨髓以及其他需要铁的细胞,为红细胞的生成和其他生理过程提供必要的铁元素。
2、参与受体介导的内吞作用:转铁蛋白与细胞膜上的转铁蛋白受体具有高度的特异性结合能力。两个负载铁的转铁蛋白分子会与一个转铁蛋白受体结合,这种结合触发了内吞作用,使得转铁蛋白及其所携带的铁离子被内吞进入细胞内部。在细胞内的酸性环境中,铁离子与转铁蛋白分离,然后被释放到细胞质中,供细胞利用。而失去铁离子的转铁蛋白(载脂蛋白 - 转铁蛋白)则会通过胞吐作用被释放回细胞外部,并再次参与铁离子的转运循环。
3、调节细胞内铁离子的水平:细胞可以通过调整转铁蛋白受体的表达量来调控从外界环境中摄取的铁量,从而维持细胞内铁离子的平衡。当细胞内铁离子浓度较低时,细胞会增加转铁蛋白受体的表达,促进转铁蛋白向细胞内转运铁离子;反之,当细胞内铁离子浓度过高时,细胞会减少转铁蛋白受体的表达,降低铁离子的摄取,防止铁离子在细胞内过度积累对细胞造成有害作用。

 2025-02-12 作者:lkr 来源:
2025-02-12 作者:lkr 来源:

