PEG-PCL-PEA(聚乙二醇-聚己内酯-聚酯酰胺)纳米粒子与细胞的相互作用是其发挥药物递送功能的核心环节,该过程涉及多阶段分子识别与动态响应机制。
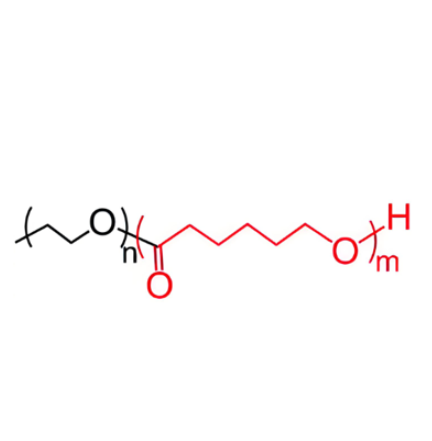
图为:PEG-PCL-PEA结构式
在初始吸附阶段,纳米粒子表面的 PEG 链段通过空间位阻效应减少非特异性蛋白吸附,降低与正常细胞的非靶向结合。而 PEA 链中的酰胺基团可通过氢键与细胞表面糖蛋白的羟基相互作用,为纳米粒子提供初始锚定位点。当纳米粒子接近tumor细胞时,其表面可能修饰的靶向配体(如 RGD 肽)会与细胞高表达的整合素受体特异性结合,提高吸附效率,这一过程的结合常数可达 10⁸-10⁹ M⁻¹。
内化过程主要依赖受体介导的胞吞作用。靶向结合触发细胞表面受体聚集,通过网格蛋白或小窝蛋白介导的内吞途径将纳米粒子包裹进入细胞,形成内体。此时,PEA 的 pH 敏感特性开始发挥作用:内体的酸性环境(pH 5.0-6.0)使 PEA 链段质子化,产生 “质子海绵效应”,破坏内体膜结构,促进纳米粒子逃逸至细胞质,避免被溶酶体降解。
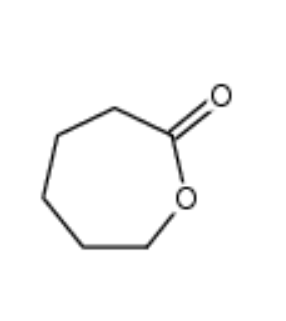
图为:聚己内酯结构式
进入胞质后,PCL 的疏水内核在酯酶作用下缓慢水解,逐步释放负载药物。同时,PEG 链的存在可减少纳米粒子与细胞器的非特异性相互作用,降低细胞有害性。研究表明,PEG 分子量为 2000 Da 时,纳米粒子的细胞摄取率与生物相容性达到平衡,而 PEA 的酰胺键密度则影响其与细胞骨架蛋白的相互作用,进而调控纳米粒子在细胞内的转运速率。
这种多层次的相互作用机制,使 PEG-PCL-PEA 纳米粒子既能高效靶向特定细胞,又能实现药物的胞内控释,为提高tumorTreatment 效果提供了重要理论依据。

 2025-08-20 作者:lkr 来源:
2025-08-20 作者:lkr 来源:

