细胞糖蛋白在众多细胞进程中发挥着关键作用,其糖基化模式的变化与多种疾病密切相关。异硫氰酸荧光素标记的小扁豆凝集素作为一种特异性识别 α- 连接甘露糖残基的荧光探针,在细胞糖蛋白谱分析中应用广泛。对基于 FITC-LCA 的分析技术进行优化,能够提升检测的准确性与效率,为深入探究细胞糖蛋白功能提供有力支持。
在样本处理环节,优化细胞培养条件至关重要。稳定且适宜的细胞培养环境,能保证细胞糖蛋白表达的一致性。调整培养基成分,准确控制serum浓度、添加特定生长因子等,可减少因培养条件波动导致的糖蛋白谱差异。同时,细胞收集时采用温和的方法,避免过度机械损伤或化学刺激,防止细胞表面糖蛋白结构改变。例如,用胰蛋白酶消化细胞时,严格把控消化时间与温度,以免影响糖蛋白与 FITC-LCA 的结合活性。
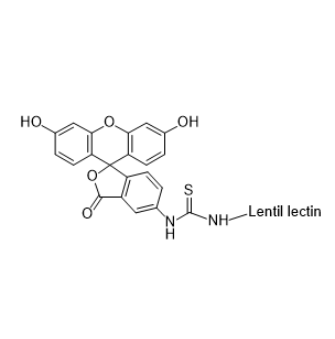
图为:FITC-LCA结构式
FITC-LCA 与细胞糖蛋白的孵育条件优化是技术关键。孵育温度、时间和 FITC-LCA 浓度均需精细调整。过低温度会使结合反应缓慢,过高则可能影响 FITC-LCA 的稳定性与糖蛋白的结构。通过实验摸索,确定多数细胞系与 FITC-LCA 的最佳孵育温度在 37℃左右。孵育时间过短,结合不充分;过长则可能导致非特异性结合增加。一般设置不同时间梯度(如 30 分钟、1 小时、2 小时)进行测试,找到最佳时间点。对于 FITC-LCA 浓度,从低浓度逐步递增,绘制结合曲线,依据荧光信号强度与背景噪音比值确定最适浓度,以实现高特异性和高灵敏度的结合效果。
检测设备与数据分析方法也有待优化。选用高分辨率、高灵敏度的荧光显微镜或流式细胞仪至关重要。共聚焦激光扫描显微镜能对细胞进行断层扫描,获取更准确的糖蛋白分布信息,减少荧光信号干扰。在数据分析时,运用专业图像分析软件,对荧光图像进行标准化处理,校正背景荧光、均一化荧光强度。还可借助机器学习算法,对大量糖蛋白谱数据进行分类、聚类分析,挖掘潜在糖蛋白标记物,提升对复杂糖蛋白谱数据的解析能力。
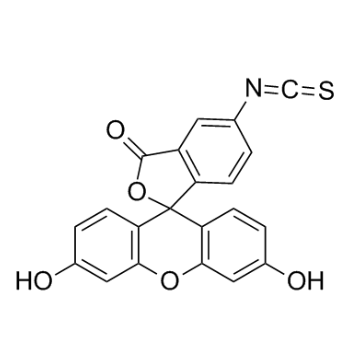
图为:FITC结构式
优化基于 FITC-LCA 的细胞糖蛋白谱分析技术,从样本处理、孵育条件到检测与数据分析全流程入手,能提高分析的准确性与深度,助力科研人员在糖生物学、疾病诊断等领域取得更具价值的研究成果,为相关领域发展注入新动力。

 2025-06-09 作者:lkr 来源:
2025-06-09 作者:lkr 来源:

