PLGA-SS-HA(聚乳酸-羟基乙酸共聚物-双硫键-透明质酸)作为一种新型药物载体材料,通过其化学结构与功能特性,可实现生物活性分子的智能缓释。以下从体系构建与性能评估两方面展开分析:
1. 缓释体系构建
材料选择与设计
PLGA作为可降解聚合物基材,提供缓释骨架;透明质酸(HA)通过双硫键(SS)与PLGA共价结合,赋予体系响应性降解能力。双硫键在还原性环境中可断裂,加速载体降解,实现药物准确释放。
制备方法
采用乳化溶剂挥发法,将生物活性分子与PLGA-SS-HA共溶于有机溶剂,通过超声乳化形成油包水乳液,再挥发溶剂形成微球。此方法可有效包裹疏水/亲水性分子,并调控微球粒径与形貌。
功能化修饰
通过调整PLGA中乳酸与羟基乙酸的比例、分子量及HA的接枝密度,可优化载体降解速率与药物释放行为。例如,增加HA含量可提高载体亲水性与靶向性,而引入双硫键则赋予其还原响应性。
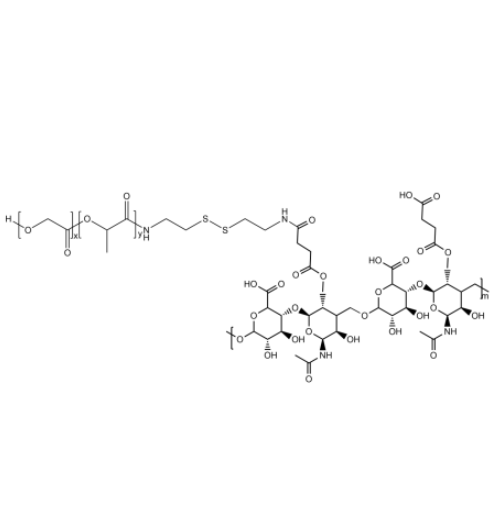
图为:PLGA-SS-HA结构式
2. 性能评估
缓释性能
体外释放实验表明,PLGA-SS-HA微球在非还原条件下(如PBS缓冲液)呈现缓慢持续释放,而在还原性环境(如含10 mM DTT的PBS)中释放速率加快。这种响应性释放行为可减少药物在正常组织中的非特异性释放,提高Treatment 效果。
生物相容性
细胞有害性实验显示,PLGA-SS-HA载体对多种细胞系(如HeLa、MCF-7)的存活率影响较小,表明其具有良好的生物相容性。此外,HA的引入可进一步提高载体与CD44受体过表达tumor细胞的靶向结合能力。
稳定性与降解性
通过扫描电子显微镜(SEM)观察微球形貌,发现其在释放过程中逐渐降解,表面出现孔隙结构,表明PLGA与HA通过双硫键断裂实现协同降解。此外,凝胶渗透色谱(GPC)分析显示,载体分子量随时间降低,进一步验证其降解特性。
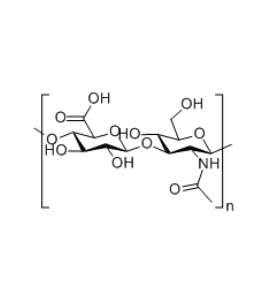
图为:透明质酸结构式
3. 应用前景与挑战
应用前景
PLGA-SS-HA缓释体系在tumorTreatment 、组织工程及再生医学领域具有应用潜力。例如,可通过负载Chemotherapy 药物实现tumor靶向Treatment ,或结合生长因子促进组织修复。
挑战与优化方向
需进一步优化载体制备工艺,提高药物包封率与负载量;同时,探索多刺激响应性载体(如pH/还原双响应)的设计,以应对复杂体内环境。此外,长期生物安全性评价与大规模生产技术也是未来研究的重点。

 2025-06-10 作者:lkr 来源:
2025-06-10 作者:lkr 来源:

