在蛋白质药物开发领域,基于马来酰亚胺-聚乙二醇-羟基的蛋白质 PEG 化修饰技术,通过共价连接聚乙二醇(PEG)链提升蛋白质稳定性与Treatment 效果。其稳定性与生物活性的平衡评估,是决定修饰策略有效性的关键。
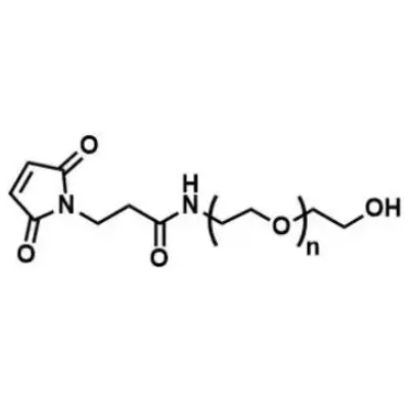
图为:MAL-PEG-OH结构式
MAL-PEG-OH 中,马来酰亚胺基团可特异性与蛋白质半胱氨酸残基的巯基反应,形成稳定的硫醚键,实现准确修饰;PEG 链则通过空间位阻效应减少蛋白质降解,降低免疫原性,延长体内半衰期。研究表明,经 PEG 化修饰的蛋白质在血清中的半衰期可延长数倍,有效减少给药频率。
稳定性评估需综合多维度指标。结构层面,圆二色谱与荧光光谱可监测蛋白质二级、三级结构变化,确保 PEG 化未破坏关键功能域;动力学研究中,加速降解实验通过高温、酸碱等严苛条件模拟,评估修饰后蛋白质抗变性能力。例如,重组人干扰素经 MAL-PEG-OH 修饰后,在 40℃环境下的降解速率降低,证实 PEG 链的保护作用。
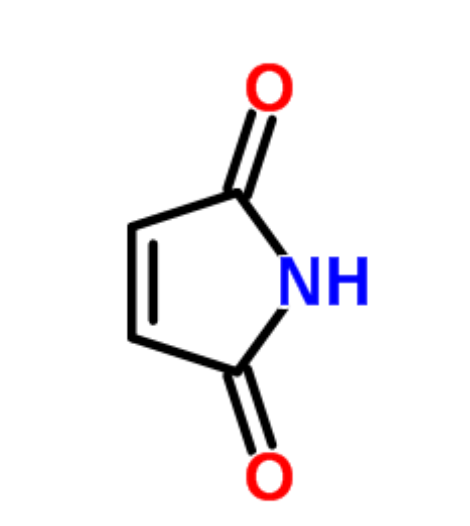
图为:MAL结构式
生物活性评估则聚焦功能保留程度。酶类蛋白质可通过测定催化活性残留率判断活性损失,如 PEG 化脲酶的催化效率若维持在 80% 以上,表明修饰策略可行;对于抗体类蛋白质,ELISA 或细胞结合实验可检测其抗原识别能力。值得注意的是,PEG 链长度与修饰位点对活性影响明显:过长的 PEG 链可能遮蔽蛋白质活性中心,而选择远离功能域的修饰位点,可将活性损失控制在最小范围。
总体而言,MAL-PEG-OH 介导的蛋白质 PEG 化修饰需通过严谨的稳定性与生物活性评估,在延长半衰期与保留功能间寻求最优解,为临床蛋白质药物开发提供可靠策略。
下转换纳米颗粒的发光机理与性能调控2025-08-01
近红外二区(NIR-II)上转换发光2025-08-01
含氟芳香结构对荧光材料量子产率的影响机制研究2025-08-01
荧光结构母核的有机染料——BODIPY荧光染料2025-08-01
上转换纳米材料的高温热解合成技术2025-08-01

 2025-07-02 作者:lkr 来源:
2025-07-02 作者:lkr 来源:

