N3-PEG4-NH2 与蛋白质的偶联技术在生物医学领域应用较广,但其对蛋白质活性的影响关乎偶联策略的有效性与实用性。探究偶联后蛋白质活性的变化规律,是优化偶联条件、拓展应用场景的关键。
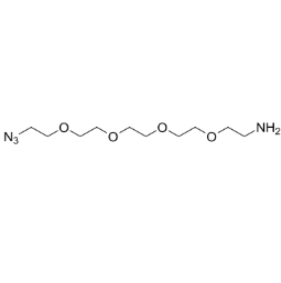
图为:N3-PEG4-NH2结构式
N3-PEG4-NH2 的双官能团结构为蛋白质修饰提供了便利:叠氮基(N3)可通过点击化学实现准确修饰,氨基(NH2)则能与蛋白质表面的羧基发生缩合反应。然而,这种化学修饰可能通过多种机制影响蛋白质活性。一方面,PEG4 链段引入的空间位阻可能改变蛋白质的构象,阻碍其与底物、受体的结合;另一方面,偶联反应可能破坏蛋白质活性中心附近的氨基酸残基,直接导致功能受损。
实验数据表明,偶联条件影响蛋白质活性。当 N3-PEG4-NH2 与蛋白质的摩尔比过高时,过度修饰会造成蛋白质聚集,降低其在溶液中的分散性,进而影响活性。例如,在辣根过氧化物酶(HRP)的偶联实验中,摩尔比超过 10:1 时,酶的催化活性残留率下降至 60% 以下。此外,反应 pH 值也至关重要:碱性过强(pH>9)时,氨基与羧基的缩合反应加速,但蛋白质易发生变性;而 pH 过低(pH<7)则导致反应不完全。优化后的反应条件(pH 8.0,摩尔比 5:1)可使 HRP 的活性残留率维持在 85% 以上。
图为:PEG结构式
值得注意的是,不同蛋白质对偶联的耐受性存在差异。结构刚性较强、活性中心远离表面的蛋白质(如血红蛋白),偶联后活性损失相对较小;而结构柔性大、活性中心暴露的蛋白质(如胰蛋白酶)则更容易受影响。因此,针对特定蛋白质需个性化调整偶联策略,通过选择合适的修饰位点、控制修饰密度,并采用温和的反应条件,最大限度保留蛋白质活性。
综上所述,N3-PEG4-NH2 与蛋白质的偶联需在功能化修饰与活性保留间寻求平衡,为其在药物递送、生物传感等领域的应用提供可靠依据。

 2025-07-02 作者:lkr 来源:
2025-07-02 作者:lkr 来源:

