文献:A smart multiantenna gene theranostic system based on the programmed assembly of hypoxia-related siRNAs
文献链接:https://www.nature.com/articles/s41467-021-24191-9
作者:Xue Gong, Haizhou Wang, Ruomeng Li, Kaiyue Tan, Jie Wei, Jing Wang, Chen Hong, Jinhua Shang,Xiaoqing Liu, Jing Liu, Fuan Wang
相关产品:ICG-NHS 吲哚菁绿-活性酯
原文摘要:The systemic therapeutic utilisation of RNA interference (RNAi) is limited by the non-specific off-target effects, which can have severe adverse impacts in clinical applications. The accurate use of RNAi requires tumour-specific on-demand conditional activation to eliminate the off-target effects of RNAi, for which conventional RNAi systems cannot be used. Herein, a tumourous biomarker-activated RNAi platform is achieved through the careful design of RNAi prodrugs in extracellular vesicles (EVs) with cancer-specific recognition/activation features. These RNAi prodrugs are assembled by splitting and reconstituting the principal siRNAs into a hybridisation chain reaction (HCR) amplification machine. EVs facilitate the specific and efficient internalisation of RNAi prodrugs into target tumour cells, where endogenous microRNAs (miRNAs) promote immediate and autonomous HCR-amplified RNAi activation to simultaneously silence multiantenna hypoxia-related genes. With multiple guaranteed cancer recognition and synergistic therapy features, the miRNA-initiated HCR-promoted RNAi cascade holds great promise for personalised theranostics that enable reliable diagnosis and programmable on-demand therapy.
ICG吲哚菁绿是一种近红外荧光染料,在近红外光区域有较强的吸收和荧光发射,能够穿透一定深度的组织,减少组织自体荧光的干扰。可以检测到非常低浓度的物质,对于一些微小病变的检测具有优势。RNA干扰(RNAi)的系统Treatment 应用受到非特异性脱靶效应的限制,这可能在临床应用中产生严重的不良影响。RNAi的准确使用需要tumor特异性的按需条件激活,以消除RNAi的脱靶效应,而传统的RNAi系统不能使用。在此,通过设计具有cancer特异性识别/激活特征的细ev中的RNAi前药,tumor生物标志物激活的RNAi平台。这些RNAi前药是通过分裂和重组主要sirna组装成杂交链反应(HCR)扩增机。ev促进了RNAi前药物进入靶tumor细胞的特异性和高效内化,内源性microRNAs(miRNAs)促进即时和自主的HCR扩增RNAi激活,从而同时沉默多天线缺氧相关基因。
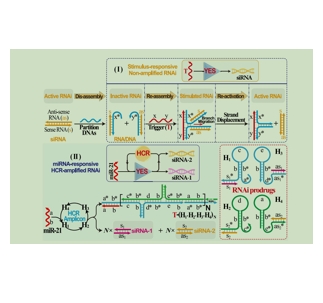
图为:刺激响应性RNAiTreatment 系统。
ICG在体外细胞有害性试验的应用:
通过评估缺氧条件下的细胞有害性,mir-21激活的HCR参与的多重RNAi操作的机制。为了研究分裂siRNA策略的普遍性,制备两对RNA/DNA杂交体作为缺氧诱导因子-1α(HIF-1α),并集成到同一个HCR放大器中。HIF-1α是由tumor内缺氧引起的,它在tumor的进展和转移中起着关键作用。
扭曲相关蛋白是HIF-1α的下游靶点,并在缺氧或HIF-1α过表达诱导的转移表型中发挥重要作用。同时抑制关键的缺氧相关信号通路可能导致增强的抗cancerTherapeutic effect 和抑制tumor进展。在这里,RNAi前药包装的ev在MDA-MB-231、MRC- 5、HeLa和MCF-7细胞中的Treatment 性能。在这些不同的细胞中,MDA-MB- 231细胞对功能性ev最敏感,这归因于ev的同源性靶向能力和随后通过HCR放大器激活双sirna。然后,用光敏剂多糖氰绿(ICG)修饰HCR发夹,以实现辅助光热Treatment (PTT)。ev封装的ICGRNAi前药的光热性能略优于仅使用ICG-RNAi前药,这是由于EVs45中ICG的凝结程度较高,散热性能较低。
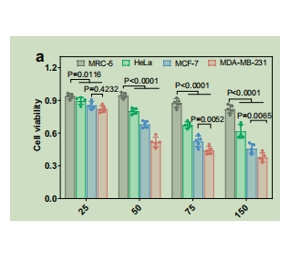
图为:缺氧条件下RNAi前药包装ev的细胞有害性评价。
结论:
RNAi的条件激活是通过将活性siRNA复杂地重组为对RNAi-无活性的RNA/DNA杂交体来实现的。通过编程的HCR放大器,暂时不活跃的RNAi系统可以被内源性miRNA特异性激活,从而极大地恢复内在的RNAi活性。通过与DNA杂交,这些rna可以被HCR发夹有效保护,而HCR发夹可以进一步封装到具有更强大的tumor靶向特征的特洛伊木马ev中。静脉注射后,这些ev通过同型靶向表现出增强的tumor特异性积累和渗透,内源性mir-21诱导的HCR导致有效的tumor识别。光敏剂ICG有效地促进了NIR照射的辅助光疗热。与体内直接的siRNA系统相比,多种保证的tumor特异性刺激RNAi表现出增强的稳定性和更长的基因测序时间。基于RNAi的拆卸/重组策略,仿生伪装ev持续HCR扩增的多天线RNAi级联激活有望为更多功能、更智能的具有临床价值的Treatment 系统铺平道路。

 2025-02-11 作者:lkr 来源:
2025-02-11 作者:lkr 来源:

