酪氨酸叠氮化修饰(即 N3-tyrosine 引入蛋白质)通过在苯环对位引入叠氮基团(-N3),改变氨基酸侧链的空间结构与化学特性,进而对蛋白质折叠过程及稳定性产生多维度影响,其效应与修饰位点、修饰程度密切相关。
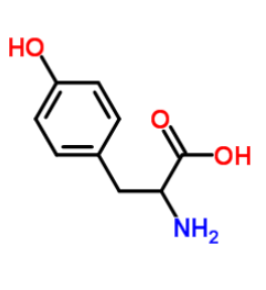
图为:N3-tyrosine结构式
在蛋白质折叠方面,修饰位点的亲疏水环境是关键调控因素。当叠氮化修饰发生在蛋白质表面暴露的酪氨酸残基时,由于叠氮基团的极性(偶极矩约 2.1 D)与水分子的相互作用,可促进局部肽段的溶剂化,加速折叠初期的二级结构(如 α- 螺旋、β- 折叠)形成,圆二色谱(CD)显示其熔融温度(Tm)较未修饰蛋白提升 1-2℃。若修饰位点位于疏水核心,叠氮基团的体积(范德华半径约 3.5 Å)会破坏原有疏水相互作用,导致折叠中间体积累,通过荧光光谱可观察到色氨酸发射峰蓝移(5-10 nm),提示疏水微环境极性增加,折叠效率降低约 15%-20%。此外,对于含酪氨酸参与的分子内氢键(如与天冬氨酸的相互作用),叠氮化会削弱氢键强度(键能降低约 5 kcal/mol),可能导致折叠路径改变,如溶菌酶的叠氮化修饰使其折叠速率常数下降 2 倍。
在稳定性调控上,修饰程度与环境适应性共同决定效应。低修饰率(<5%)时,蛋白质整体结构保持完整,叠氮基团的空间位阻可减少蛋白酶的识别位点,使血清中的半衰期延长 1.5-2 倍(如抗体药物偶联物)。高修饰率(>10%)则可能引发聚集,动态光散射(DLS)显示其粒径增加 20-50 nm,这与疏水核心暴露后的分子间相互作用增强相关。在极端条件下,叠氮化修饰展现双重作用:酸性环境(pH 3.0)中,修饰蛋白的聚集率较未修饰组降低 30%,因叠氮基团的质子化增强了分子间斥力;而高温(60℃)下,修饰蛋白的解折叠速率加快(t1/2 缩短 15%),热重分析(TGA)显示其热分解温度下降 3-5℃,提示叠氮基团可能通过电子效应影响肽键稳定性。
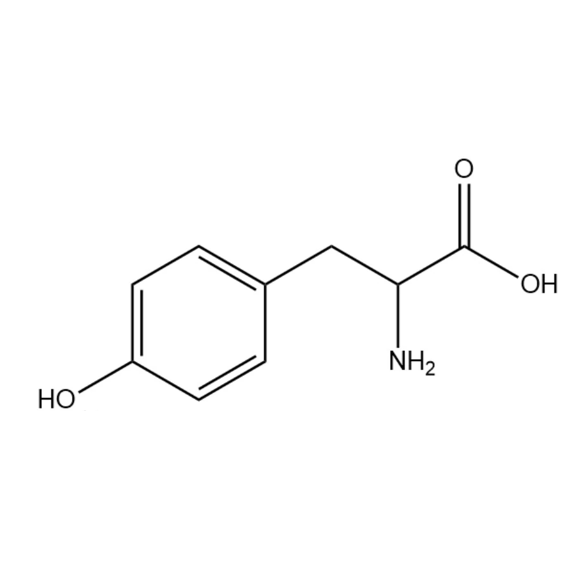
图为:酪氨酸结构式
值得注意的是,通过定点修饰技术(如基因编码)将叠氮酪氨酸引入非关键位点(如柔性 loop 区),可在维持折叠正确性的同时提升稳定性。例如,绿色荧光蛋白(GFP)的表面酪氨酸叠氮化后,其荧光量子产率保留 90% 以上,且在反复冻融循环中活性损失减少 40%。这为平衡修饰功能性与蛋白质稳定性提供了设计思路,推动其在生物偶联与药物开发中的应用。

 2025-07-17 作者:lkr 来源:
2025-07-17 作者:lkr 来源:

