基于 ICG-Dextran 构建的细胞靶向递送系统,兼具荧光示踪与靶向递送功能,在准确Treatment 领域极具应用潜力。ICG(吲哚菁绿)的近红外荧光特性可实现实时监测,葡聚糖(Dextran)的亲水性与生物相容性为载体提供良好的生物安全性,二者结合为多功能递送系统奠定基础。
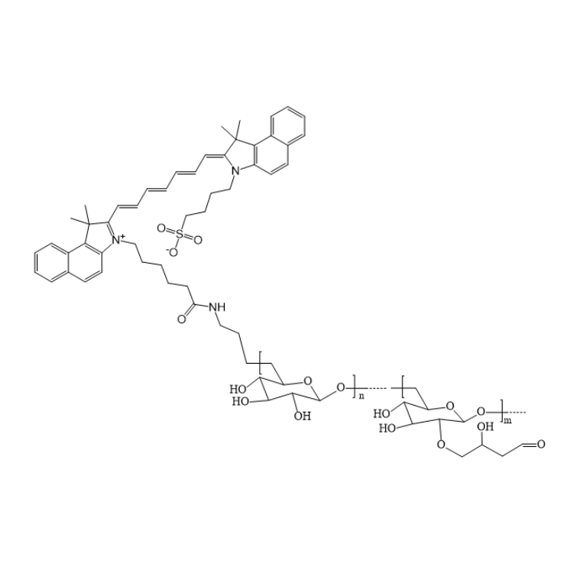
图为:ICG-Dextran结构式
构建该系统的核心是通过化学修饰引入靶向配体。利用葡聚糖的羟基活性,可与靶向分子(如 RGD 肽、叶酸、抗体片段)共价偶联。例如,RGD 肽能特异性识别tumor细胞表面的整合素受体,通过酰胺键连接至 ICG-Dextran 后,载体可通过受体介导的内吞作用富集于tumor细胞,提升靶向效率。此外,可采用乳化-溶剂挥发法制备纳米级递送系统,将药物包载于 ICG-Dextran 形成的纳米粒中,借助纳米尺寸效应增强tumor穿透性。
优化策略需聚焦于提升靶向准度与递送效率。在靶向配体选择上,需匹配靶细胞表面高表达受体,如针对liver cancer细胞选择抗 EGFR 抗体,可使靶向效率提升 2-3 倍。载体粒径调控至 100-200 nm 为宜,此范围既能避免被网状内皮系统过快清除,又能通过Blood vessels内皮间隙富集于病变组织。
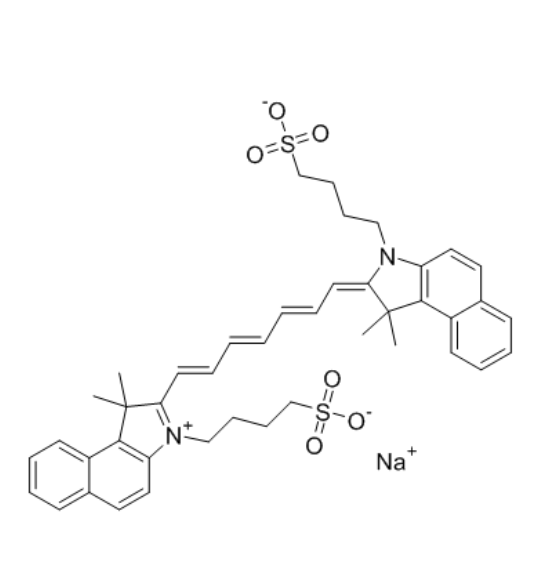
图为:ICG结构式
此外,通过 PEG 修饰可减少非特异性吸附,延长系统血液循环时间;调节 ICG 与葡聚糖的偶联比例,可平衡荧光强度与靶向活性。体外实验显示,经优化的靶向递送系统对 SKOV3 oophoroma细胞的摄取量较非靶向组提高 4.1 倍,且药物释放具有 pH 响应性,在酸性tumor微环境中释放速率加快,实现准确释药。

 2025-07-18 作者:lkr 来源:
2025-07-18 作者:lkr 来源:

