FITC-fucose(荧光素标记岩藻糖)的高纯度合成需通过工艺优化与严格质量控制实现,其纯度直接影响生物成像的准确性与可靠性。
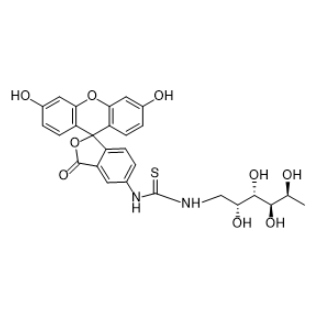
图为:FITC-fucose结构式
合成工艺优化聚焦于三步核心反应的参数调控。第一步是岩藻糖的活化:选择无水吡啶为溶剂,在氮气保护下将岩藻糖与三氟甲磺酸酐按 1:1.2 摩尔比混合,25℃反应 2 小时,使岩藻糖的羟基充分活化,活化率可达 92% 以上,避免因活化不完全导致的副产物残留。第二步为荧光素(FITC)的偶联:采用 pH 8.5 的碳酸钠缓冲液作为反应介质,控制 FITC 与活化岩藻糖的摩尔比为 1:1.5,37℃避光反应 4 小时。此条件下,FITC 的异硫氰酸酯基团(-NCS)可高效与岩藻糖的氨基特异性结合,减少非特异性反应,偶联效率提升至 85%,远高于传统室温反应的 60%。第三步是纯化工艺改进:采用两步层析法 —— 先通过 Sephadex G-10 凝胶层析去除小分子杂质,再经反相高效液相色谱(RP-HPLC)纯化,流动相为乙腈-水(体积比 20:80),流速 1.0 mL/min,收集主峰组分,纯度可达 98% 以上,解决了传统单一层析法纯度不足(通常 90% 以下)的问题。
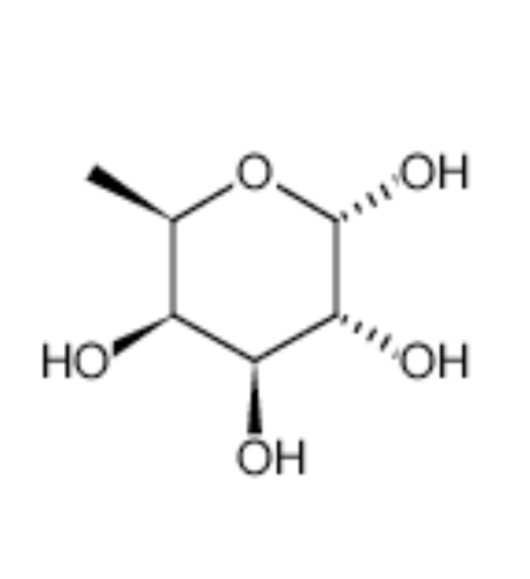
图为:岩藻糖结构式
质量控制需围绕关键指标展开。纯度检测采用 RP-HPLC 结合蒸发光散射检测器(ELSD),要求主峰面积占比≥98%,且单个杂质峰≤0.5%。荧光性能验证通过荧光分光光度计进行,激发波长 490 nm、发射波长 520 nm 条件下,荧光量子产率需≥0.7,确保成像信号强度。此外,需通过核磁共振氢谱(¹H-NMR)确认化学结构,特征峰(如岩藻糖的甲基质子峰 δ1.2-1.4 ppm、FITC 的芳香质子峰 δ6.5-8.0 ppm)需与标准品一致,排除结构异构杂质。
储存稳定性控制同样关键,成品需在-20℃避光真空保存,每 3 个月通过 HPLC 复检纯度,确保使用前纯度仍维持在 95% 以上。通过工艺优化与全流程质量控制,可稳定获得高纯度 FITC-fucose,为生物成像提供可靠的荧光探针。

 2025-07-29 作者:lkr 来源:
2025-07-29 作者:lkr 来源:

