PLGA/羟基磷灰石(HA)复合微球结合了 PLGA 的可降解性与 HA 的生物活性,在药物递送和骨组织工程中极具应用价值,其制备方法与降解行为的研究备受关注。
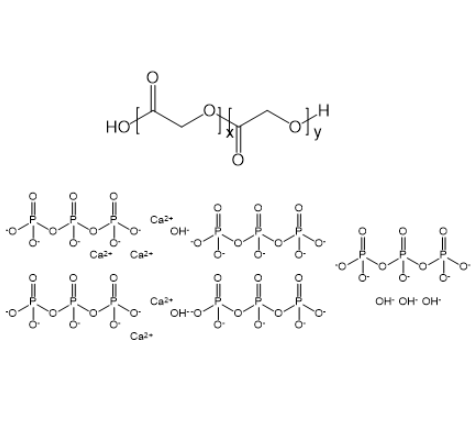
图为:PLGA-hydroxyapatite结构式
复合微球的制备常采用乳化-溶剂挥发法。将 PLGA 溶于二氯甲烷等有机溶剂形成油相,HA 粉末分散于含表面活性剂的水相,通过超声乳化形成水包油乳液。搅拌过程中有机溶剂挥发,PLGA 固化成球,HA 颗粒被包裹其中。调节搅拌速率可控制微球粒径,转速越高粒径越小(通常在 50-500μm 范围)。此外,静电喷雾法能制备纳米级复合微球,通过高压电场使聚合物溶液雾化成滴,溶剂挥发后形成结构均一的微球,HA 的引入可增强微球的力学强度。
复合微球的降解行为受 HA 含量、微球结构及环境因素影响。PLGA 通过酯键水解降解,产生酸性产物,而 HA 的碱性可中和局部酸性,缓解 pH 骤降导致的Inflammation反应。体外降解实验显示,HA 含量为 10%-30% 时,复合微球降解速率较纯 PLGA 更平缓。低 HA 含量(<10%)时,微球降解以 PLGA 水解为主,后期因 HA 暴露加速降解;高 HA 含量(>30%)时,HA 形成连续相,抑制 PLGA 链段运动,降解速率减慢。
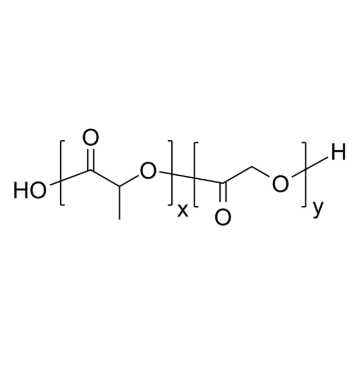
图为:PLGA结构式
微球的多孔结构会加速降解,孔隙为水分渗透提供通道,促进 PLGA 水解。在模拟体液中,HA 可诱导羟基磷灰石沉积,形成类骨矿化层,延缓 PLGA 降解的同时增强与骨组织的结合。体内降解研究表明,复合微球在骨缺损部位的降解周期与新骨形成速率匹配,3 个月后重量保留率约 40%-60%,优于纯 PLGA 的快速崩解。
综上,PLGA/HA 复合微球的制备可通过工艺调控实现性能优化,其降解行为的可控性使其在骨修复领域具有优势,为开发新型骨替代材料提供了重要依据。

 2025-07-31 作者:lkr 来源:
2025-07-31 作者:lkr 来源:

