生物素修饰卵清蛋白(OVA-BIOTIN)在生物医学和生命科学研究领域应用较广,如免疫检测、细胞标记等。其稳定性对于实验结果的准确性和可靠性至关重要,而诸多因素会对其稳定性产生影响。
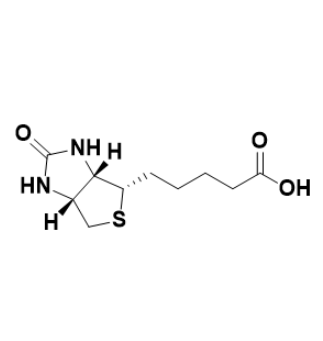
图为:OVA-BIOTIN结构式
从结构上看,卵清蛋白本身由单一多肽链构成,二硫键和氢键维系着它的四级结构,这对其稳定性起着关键作用。当生物素通过共价键连接到卵清蛋白分子上后,新形成的 OVA-BIOTIN 共轭物结构变得更为复杂。生物素虽相对分子质量较小,通常对卵清蛋白原有结构影响不大,但修饰位点和修饰程度会对整体稳定性有不同程度的作用。
温度是影响 OVA-BIOTIN 稳定性的重要因素。卵清蛋白在高温下易变性,OVA-BIOTIN 同样如此。研究显示,温度升高时,卵清蛋白分子振动加剧,维系结构的化学键易被破坏,从而使稳定性降低。当温度达到 60℃以上,卵清蛋白的溶解度明显下降,OVA-BIOTIN 的活性和结构完整性也会受影响。在低温环境下,如 4℃及以下,分子运动减缓,化学反应速率降低,可有效减缓其降解速度,因此低温储存对维持其稳定性意义重大。
pH 值的改变也会影响 OVA-BIOTIN 稳定性。卵清蛋白的等电点约为 4.5,当处于酸性或碱性较强的环境中,其电荷状态改变,分子间相互作用受到影响,导致结构稳定性下降。对于 OVA-BIOTIN 而言,极端 pH 值(pH 4.0 以下或 pH 9.0 以上)会使生物素与卵清蛋白间的连接以及卵清蛋白自身结构遭到破坏,致使稳定性降低。合适的 pH 值环境能确保分子处于稳定状态,一般接近中性的 pH 值(如 pH 7.2-7.4 的 PBS 缓冲液)有利于维持其稳定性。
氧化还原条件对 OVA-BIOTIN 稳定性影响明显。卵清蛋白含有硫醇基团,在氧化条件下,如高氧气浓度或存在氧化剂时,硫醇基团易被氧化,破坏卵清蛋白的三维结构,进而影响 OVA-BIOTIN 稳定性。而在还原条件下,如添加适量还原剂或处于低氧气浓度环境,可减少氧化反应发生,相对提高其稳定性。
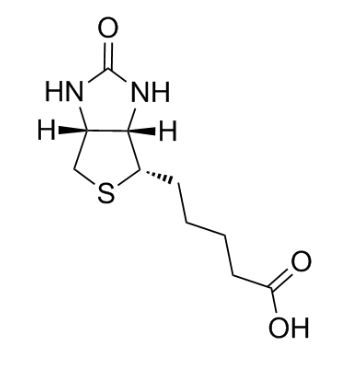
图为:生物素结构式
此外,有机溶剂、重金属离子、酶以及加工处理等因素也不容忽视。有机溶剂可能破坏蛋白质的氢键和疏水作用,重金属离子会与蛋白质中的硫醇基团反应,某些酶(如蛋白酶)会直接作用于卵清蛋白使其降解,过度的加工处理(如高温长时间加热、剧烈机械搅拌)同样会破坏其结构,这些都会降低 OVA-BIOTIN 的稳定性。
了解这些影响因素,在制备、储存和使用 OVA-BIOTIN 时,严格控制温度、pH 值,避免接触有机溶剂、重金属离子和酶,选择合适的加工处理方式,可有效维持其稳定性,确保实验结果的可靠性和重复性。

 2025-08-04 作者:lkr 来源:
2025-08-04 作者:lkr 来源:

