在靶向药物递送领域,叶酸(FA)修饰的载体因能特异性识别tumor细胞表面高表达的叶酸受体,备受关注。PLL-PEG-FA 作为其中一员,与其他常见叶酸靶向载体,如 PLGA-PEG-FA、PLA-PEG-FA 等相比,各有优劣。
从结构上看,PLL-PEG-FA 由聚赖氨酸(PLL)、聚乙二醇(PEG)和叶酸组成。PLL 带正电,可与带负电的药物或基因通过静电作用结合,PEG 增强亲水性与生物相容性,FA 赋予靶向性。PLGA-PEG-FA 中的聚乳酸-羟基乙酸共聚物(PLGA)具有良好的生物可降解性,能包裹疏水药物,PEG 和 FA 作用类似。PLA-PEG-FA 则以聚乳酸(PLA)为疏水段。与 PLGA、PLA 类载体相比,PLL-PEG-FA 中 PLL 的正电荷使其在结合核酸类药物时更具优势,结合力更强,如在递送 siRNA 时,PLL-PEG-FA 形成的复合物稳定性高于 PLGA-PEG-FA,不易在血液中解离。
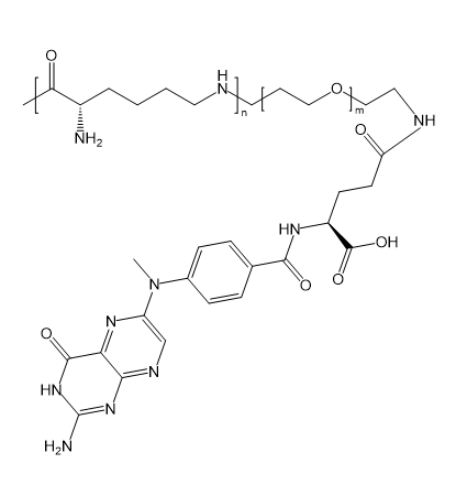
图为:PLL-PEG-FA结构式
靶向性能方面,多种载体均依赖 FA 与叶酸受体的特异性结合。研究表明,在叶酸受体阳性的 HeLa 细胞实验中,PLL-PEG-FA、PLGA-PEG-FA 和 PLA-PEG-FA 都能提高细胞摄取。但 PLGA-PEG-FA 由于 PLGA 疏水性较强,自组装形成的纳米粒粒径相对较大(约 100-150nm),在血液循环中易被单核巨噬细胞系统识别和清除,影响到达靶细胞的量。PLL-PEG-FA 经优化后,粒径可控制在 80-120nm,且表面电荷有助于其与细胞表面相互作用,细胞摄取效率略高于 PLA-PEG-FA,在相同孵育时间内,PLL-PEG-FA 进入细胞的量比 PLA-PEG-FA 多 20% 左右。
药物负载与释放性能差异明显。PLGA 和 PLA 的疏水性使 PLGA-PEG-FA、PLA-PEG-FA 在负载疏水药物时表现出色,包封率较高,如对紫杉醇的包封率可达 80% 以上。PLL-PEG-FA 更适合负载亲水性药物或核酸类物质,通过调节 PLL 与药物的比例可实现一定程度的负载量调控。在释放方面,PLGA-PEG-FA 在模拟溶酶体酸性环境(pH 5.5)下能快速释放负载药物,累积释药率 > 80%,而 PLL-PEG-FA 对药物的释放受环境 pH 影响较小,主要通过 PLL 的降解或与药物结合力的改变实现缓慢释放,在tumorTreatment 中,这种持续释放特性有利于维持药物在tumor部位的有效浓度。
图为:叶酸结构式
PLL-PEG-FA 在结合核酸药物、细胞摄取及对亲水性药物的负载与释放方面有独特优势,虽在体内循环稳定性上略逊于部分载体,但在特定药物递送场景中,如基因Treatment 、亲水性药物靶向输送等,具有广阔应用前景,与其他叶酸靶向载体形成互补,共同推动靶向药物递送技术发展。

 2025-08-08 作者:lkr 来源:
2025-08-08 作者:lkr 来源:

