PLGA-MAN(聚乳酸-羟基乙酸共聚物-甘露糖)的靶向特异性源于准确的结构设计,通过调控载体骨架、靶向配体及连接方式,可实现对特定细胞或组织的选择性识别。
PLGA 骨架的理化性质是靶向调控的基础。调整 PLGA 的分子量与乳酸 / 羟基乙酸比例,可改变载体的亲疏水性与降解速率。例如,低分子量 PLGA(5k-10kDa)形成的纳米粒粒径更小(50-100nm),易穿透Blood vessel endothelial barrier,靶向深部组织;高比例乳酸成分则增强载体的疏水性,利于与细胞膜的初始吸附。这种结构设计使载体在循环系统中优先富集于高通透性的tumor或Inflammation部位,形成被动靶向基础。
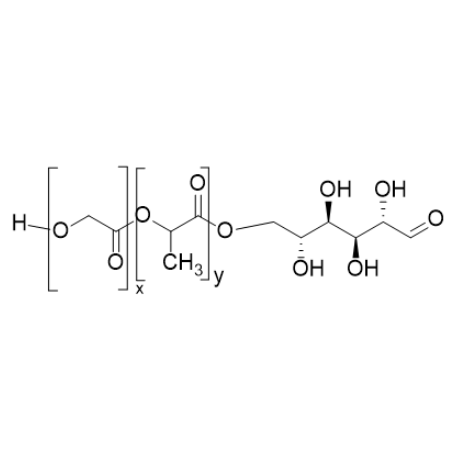
图为:PLGA-MAN结构式
甘露糖配体的修饰方式直接影响靶向准度。通过控制甘露糖的修饰密度(每分子 PLGA 连接 2-5 个甘露糖残基),可利用多价效应增强与细胞表面甘露糖受体的结合力。当修饰密度过低时,难以形成有效识别;过高则可能因空间位阻导致受体结合效率下降。此外,甘露糖的连接位点选择至关重要 —— 将其接枝于 PLGA 链的末端而非侧链,可减少配体之间的相互干扰,保持与受体结合的最佳构象。
间隔臂的引入是优化靶向特异性的关键策略。在 PLGA 与甘露糖之间插入聚乙二醇(PEG)短链,既能避免 PLGA 的疏水核心对配体的遮蔽,又能延长甘露糖的空间伸展距离,使其更易与受体结合。实验表明,含 500Da PEG 间隔臂的 PLGA-MAN,对巨噬细胞的靶向结合效率较直接连接方式提升 3 倍。
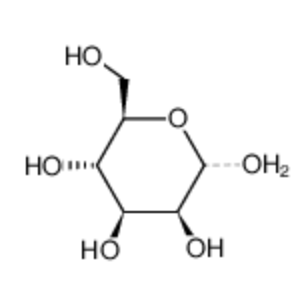
图为:甘露糖结构式
此外,载体的表面电荷调控可增强靶向特异性。通过在 PLGA 末端引入氨基或羧基,使载体表面带弱正电(ζ 电位 + 5-+15mV),可与带负电的细胞表面产生静电吸引,辅助甘露糖受体的特异性识别,同时避免非特异性吸附。
综上,PLGA-MAN 的靶向特异性是骨架结构、配体密度、连接方式及表面电荷协同调控的结果,通过模块化结构设计,可准确匹配不同靶标细胞的受体特征,为靶向递送提供高效调控手段。

 2025-08-13 作者:lkr 来源:
2025-08-13 作者:lkr 来源:

