1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-顺铂作为一种新型磷脂衍生物,在构建自组装纳米结构方面展现出独特优势,其通过化学修饰将顺铂(DDP)与磷脂分子结合,不仅增强了脂质体的稳定性,还赋予了纳米结构一定的靶向性。
一、自组装纳米结构的构建
DSPE-DDP的自组装过程主要依赖于其两亲性特性。DSPE部分具有亲脂性,能够与其他脂质分子相互作用,形成稳定的脂质双层结构;而顺铂的偶联则通过共价键与磷脂分子结合,增强了纳米结构的稳定性。在构建过程中,DSPE-DDP可以通过薄膜水化法、逆向蒸发法等方法与其他脂质成分(如胆固醇、DSPE-PEG)共同形成脂质体。这些脂质体在溶液中能够自发地聚集,形成具有特定尺寸和形态的纳米结构。
为了优化纳米结构的性能,可以调控DSPE-DDP与其他脂质成分的比例。例如,增加DSPE-PEG的比例可以提高纳米结构的blood循环时间和生物相容性,减少被网状内皮系统(RES)快速清除的风险。此外,通过调整水化介质、超声条件等参数,也可以进一步控制纳米结构的尺寸和形态。
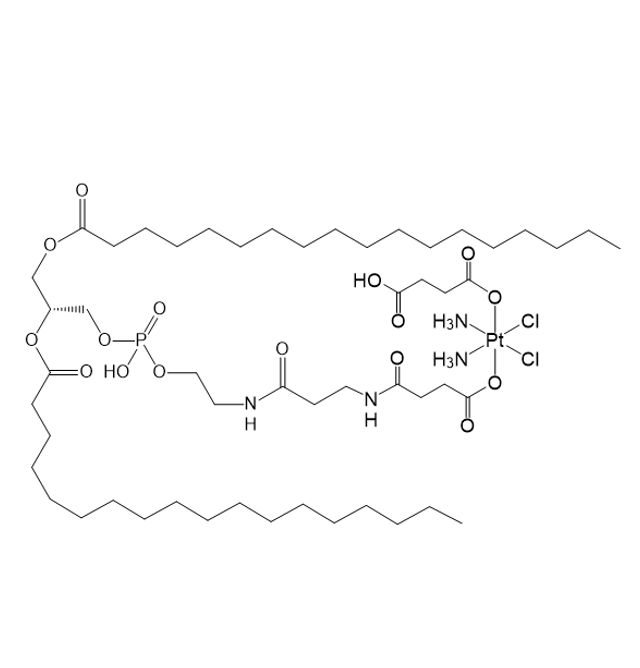
图为:DSPE-DDP结构式
二、性能调控
DSPE-DDP自组装纳米结构的性能调控主要关注其稳定性、靶向性和药物释放行为。在稳定性方面,通过引入DSPE-PEG等亲水性聚合物,可以形成刷状PEG构象,有效屏蔽纳米结构表面的电荷和疏水性,减少非特异性吸附和聚集。在靶向性方面,可以进一步修饰DSPE-DDP纳米结构,如连接抗体、多肽等靶向分子,实现对特定细胞或组织的准确递送。
药物释放行为是DSPE-DDP自组装纳米结构性能调控的另一个重要方面。顺铂的偶联使得药物被限制在脂质体内部,减少了在正常组织中的分布。通过调控纳米结构的组成和形态,可以控制药物的释放速率和释放量。例如,增加脂质双层中DSPE-DDP的比例可以减缓药物的释放速率,延长药物在体内的循环时间。
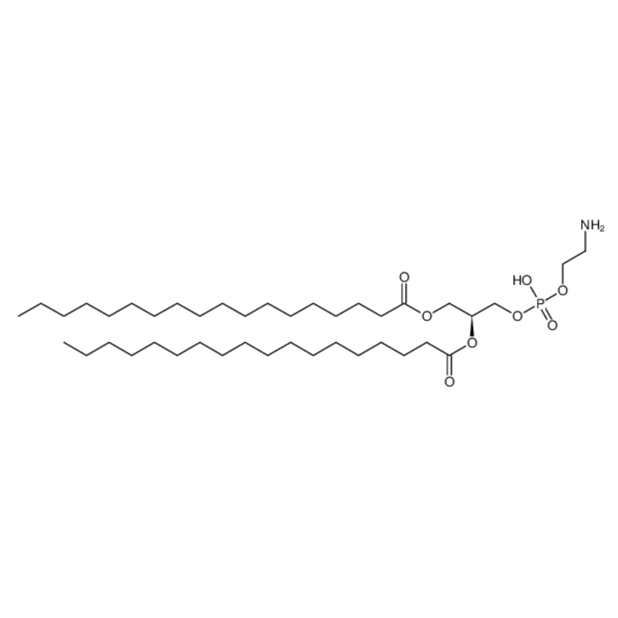
图为:DSPE结构式
三、未来展望
随着纳米技术的发展,基于DSPE-DDP的自组装纳米结构在药物递送、生物成像等领域展现出巨大潜力。未来,通过进一步优化纳米结构的构建方法和性能调控策略,可以实现更高效、更稳定的药物递送系统。同时,结合其他技术(如基因编辑技术、纳米机器人技术),DSPE-DDP自组装纳米结构有望在医疗和个体化Treatment 中发挥更大作用。

 2025-06-05 作者:lkr 来源:
2025-06-05 作者:lkr 来源:

