在基因Treatment 、基因功能研究等领域,高效地将核酸导入细胞是关键环节。脂质体作为常用的非virus基因载体,能与核酸形成脂质体-核酸复合物,实现基因递送。其中,DSPE-PEG-DC对复合物转染效率有着重要影响。
DSPE-PEG-DC 由磷脂、聚乙二醇和去氧胆酸组成。DSPE 可插入脂质体或细胞膜,稳定药物载体;PEG 形成水相保护层,避免immunity清除,延长纳米药物在体内的循环时间;DCA 增强载体与细胞膜的相互作用,促进药物跨膜转运和细胞摄取。其独特结构能改善脂质体-核酸复合物的性能,提高转染效率。
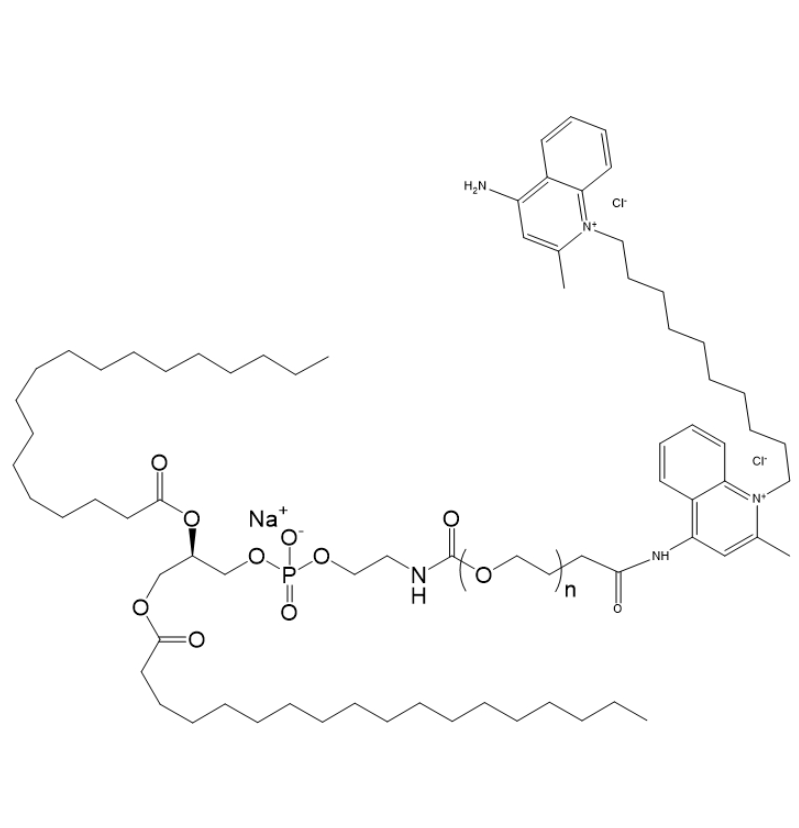
图为:DSPE-PEG-DC结构式
影响转染效率的因素众多。脂质体与核酸的比例至关重要,合适的比例能使复合物结构稳定,利于细胞摄取。一般而言,需通过预实验确定最佳比例,如在某些实验中,特定脂质体与核酸质量比为 3:1 时转染效率达峰值,过量脂质则引发细胞有害性,降低细胞活性。复合物粒径和表面电荷也不容忽视。粒径适中、表面电荷合适的复合物,更易被细胞摄取。比如,较小粒径的复合物扩散速率快,能更高效地接近细胞;而合适的表面电荷有助于复合物与带负电的细胞膜相互作用。
细胞状态同样影响转染效果。处于对数生长期、细胞密度适中(70%-80% 汇合度)的细胞,转染效率更高。这是因为此时细胞代谢活跃,对外部物质的摄取能力较强。为优化转染效率,可从多方面着手。调整 DSPE-PEG-DC 在脂质体配方中的比例,实验表明,改变其含量会影响脂质体的稳定性、与核酸的结合能力以及与细胞膜的相互作用,进而改变转染效率,需摸索出最佳配方比例。优化转染条件,如采用无serum或低serum缓冲液制备复合物,减少非特异性结合;控制转染时间和温度,通常 37°C、接近生理 pH 值(7.4)时转染效率最佳;转染后适时更换新鲜培养基,去除未结合的脂质体复合物,降低细胞有害性。
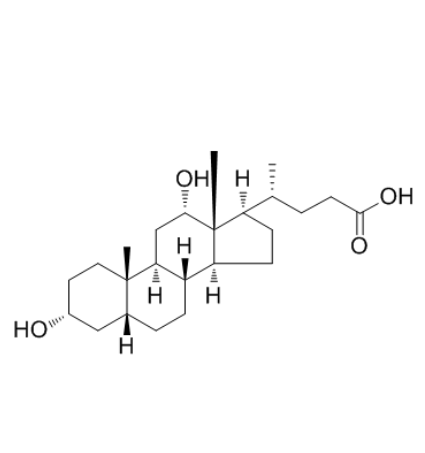
图为:去氧胆酸结构式
此外,针对不同细胞类型的特性,开发特异性转染方案。例如,神经元细胞等转染效率低的细胞,可通过调整脂质体配方、添加靶向分子等方法提高转染效率。通过这些优化策略,有望提升 DSPE-PEG-DC 介导的脂质体-核酸复合物转染效率,推动相关领域研究进展。

 2025-06-30 作者:lkr 来源:
2025-06-30 作者:lkr 来源:

