文献:Theranostic Liposomes with Hypoxia-Activated Prodrug to Effectively Destruct Hypoxic Tumors post Photodynamic Therapy
文献链接:https://med.wanfangdata.com.cn/
作者:Liangzhu Feng, Liang Cheng, Ziliang Dong, Danlei Tao, Todd E. Barnhart, Weibo Cai, Meiwan Chen, and Zhuang Liu
相关产品:DPPC 二棕榈酰磷脂酰胆碱
原文摘要:Photodynamic therapy (PDT), a noninvasive cancer therapeutic method triggered by light, would lead to severe tumor hypoxia after treatment. Utilizing a hypoxia activated prodrug, AQ4N, which only shows toxicity to cancer cells under hypoxic environment, herein, a multipurpose liposome is prepared by encapsulating hydrophilic AQ4N and hydrophobic hexadecylamine conjugated chlorin e6 (hCe6), a photosensitizer, into its aqueous cavity and hydrophobic bilayer, respectively. After chelating 64Cu isotope with Ce6, the obtained AQ4N- Cu-hCe6-liposome is demonstrated to be an effective imaging probe for in vivo positron emission tomography (PET), which together with in vivo fluorescence and photoacoustic imaging uncovers efficient passive homing of those liposomes after intravenous injection. After being irradiated with the 660-nm light emitting diode (LED) light, the tumor bearing mice with injection of AQ4N-hCe6-liposome show severe tumor hypoxia, which in turn would trigger activation of AQ4N, and finally contributes to remarkably improved cancer treatment outcomes via sequential PDT and hypoxia activated chemotherapy. This work highlights a liposome-based theranostic nanomedicine that could utilize tumor hypoxia, a side effect of PDT, to trigger chemotherapy, resulting in greatly improved efficacy compared to conventional cancer PDT.
DPPC是一种重要的磷脂成分,存在于生物膜中,特别是肺表面活性物质。DPPC的分子结构由一个亲水的胆碱头部和一个疏水的脂肪酸尾部组成。具体来说,它包含两个棕榈酰基团(C16:0)与甘油-3-磷酸的1,2-位酯化,而胆碱则与甘油-3-磷酸的3-位酯化形成的磷酸酯键相连。该文献介绍AQ4N-hCe6-liposome 是一种脂质体体系。在 AQ4N-hCe6-liposome 中,AQ4N 被包裹在脂质体内部,通过脂质体的递送作用,提高其在体内的稳定性和靶向性。DPPC 在 AQ4N-hCe6-liposome 的制备中起着关键作用,包括构建脂质体膜、影响脂质体的稳定性和药物释放特性,以及与药物相互作用,为实现有效的药物递送提供了重要的基础。
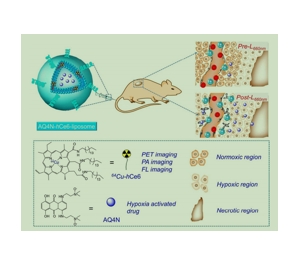
图为:aq4n-hCe6-脂质体的化学组成方案
DPPC在AQ4N-hCe6-liposome制备中的应用:
为了成功制备 AQ4N-hCe6-liposome,将 DPPC以及 hCe6 等脂质混合物溶解在氯仿当中随后,将该溶液置于旋转蒸发器之下进行干燥处理。在这一过程中,旋转蒸发器通过降低压力和加热,使氯仿逐渐挥发,留下脂质混合物在容器壁上形成一层均匀的薄膜。接着,使用 AQ4N 溶液对干燥后的脂质薄膜进行水合。在搅拌的作用下,AQ4N 溶液与脂质薄膜充分接触,促使脂质分子重新排列形成脂质体结构,同时将 AQ4N 和 hCe6 包裹在脂质体内部。之后,将得到的混合物在聚碳酸酯过滤器下进行挤压。聚碳酸酯过滤器具有特定的孔径大小,可以控制脂质体的粒径分布,使制备出的脂质体更加均匀。为了去除未被封装的 AQ4N,将混合物通过运行 sephadex G-50 柱。Sephadex G-50 柱利用分子筛的原理,根据分子大小的不同对混合物进行分离。未被封装的 AQ4N 分子会在特定的条件下与脂质体分离,从而得到较为纯净的 AQ4N-hCe6-liposome。最后,将获得的 AQ4N-hCe6-liposome 与 Amico 过滤装置进行浓缩处理,以便于进一步的使用和研究。而纯 hCe6-liposome 的制备方法与 AQ4N-hCe6-liposome 的制备方法大致相同。同样是将 DPPC、胆固醇、DSPE-mPEG5k 和 hCe6 的脂质混合物溶解在氯仿中并进行干燥处理,然后用适当的溶液进行水合和搅拌,再经过聚碳酸酯过滤器挤压。但是在整个制备过程中不添加 AQ4N,这样就可以得到只含有 hCe6 的纯 hCe6-liposome。
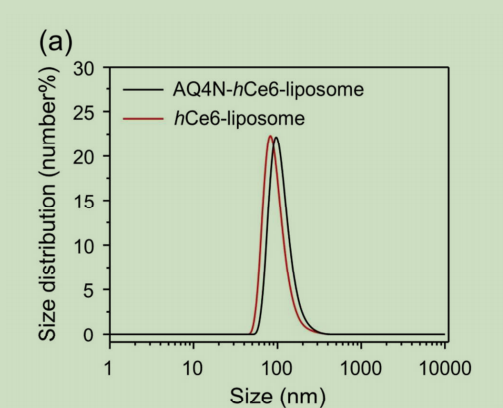
图为:aq4n-hce6-脂质体的表征
结论:在 AQ4N-hCe6-liposome(一种载药脂质体)的制备中,二棕榈酰磷脂酰胆碱(DPPC)有着重要的应用。DPPC 具有典型的磷脂结构,包含亲水性的头部和两条疏水性的脂肪酸链。在制备脂质体时,多个 DPPC 分子通过疏水作用,其脂肪酸链相互聚集,而亲水性头部朝向外侧,形成脂质双分子层结构。这种脂质双分子层构成了脂质体的基本骨架,为包裹药物 AQ4N 和 hCe6 提供了空间。AQ4N 和 hCe6 可以被包裹在由 DPPC 等磷脂组成的脂质体内部。DPPC 的疏水性区域可以与疏水性药物相互作用,增加药物的溶解度和稳定性。同时,脂质体的亲水性外部环境可以保护药物免受外界环境的影响,如酶的降解和免疫系统的攻击。

 2025-07-21 作者:lkr 来源:
2025-07-21 作者:lkr 来源:

