PLGA(聚乳酸-羟基乙酸共聚物)作为可降解医用高分子材料的代表,通过微球化技术实现了药物递送、组织再生及生物传感等多场景应用。其降解速率可通过单体比例调控、表面修饰及结构工程化设计,与药物释放动力学、生物活性保持及体内免疫响应形成耦合。以下从材料特性、制备工艺、药物递送机制等维度展开系统性分析:

一、材料特性
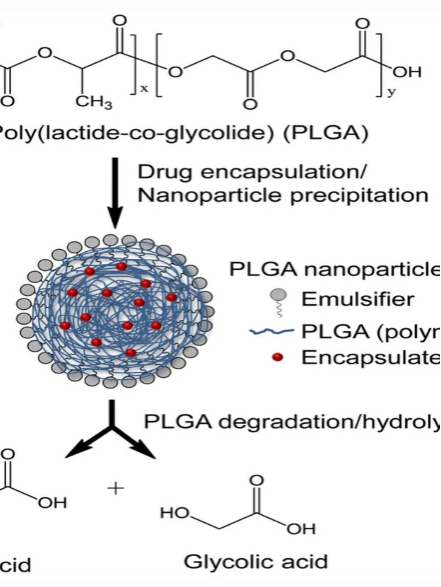
可降解性:PLGA由乳酸(LA)和乙醇酸(GA)共聚而成,降解速率可通过LA/GA比例调控。高GA含量(如PLGA 50:50)降解快,适用于短期释放;高LA含量(如PLGA 75:25)降解慢,适合长效制剂。降解产物为乳酸和羟基乙酸,可经代谢排出体外。
生物相容性:PLGA降解产物安全,适用于长期植入或注射给药。
功能可定制性:通过调整PLGA分子量、粒径、表面修饰及内部结构(如核壳、多孔),可实现药物缓释、靶向递送或响应性释放。
二、制备方法
乳化-溶剂挥发法:
单乳法(O/W):将PLGA和疏水性药物溶于有机溶剂(如二氯甲烷),加入含乳化剂的水相,搅拌形成油包水乳液,挥发溶剂后固化微球。适用于脂溶性药物,粒径1-10μm。
复乳法(W/O/W):将水溶性药物溶于内水相,包裹于PLGA有机溶液形成初乳(W/O),再分散于外水相形成复乳(W/O/W),挥发溶剂后得微球。可保护蛋白质活性,粒径10-100μm。
喷雾干燥法:将PLGA和药物溶液雾化后,通过热气流快速干燥,形成微球。适用于热敏性药物,粒径1-10μm,但易发生药物结晶或聚集。
微流控技术:通过微通道准确控制流体混合,形成单分散微球。粒径均一性高(CV<5%),适合制备复杂结构(如Janus微球)。
超临界流体法:利用超临界CO₂替代有机溶剂,制备无溶剂残留的微球,适合蛋白质类药物。
三、特性与优势
材料可调控性
降解速率:乳酸(LA)与乙醇酸(GA)单体的比例(如PLGA 75:25、50:50)直接影响共聚物亲水性及降解速度。
机械性能:通过分子量(5-100 kDa)及交联密度调节,可实现从软质水凝胶到硬质支架的力学范围覆盖,匹配不同组织修复需求。
表面改性:接枝聚乙二醇(PEG)、透明质酸(HA)或细胞黏附肽(如RGD),可增强微球体内循环稳定性或靶向性。
生物安全性
降解产物为乳酸和羟基乙酸,通过三羧酸循环完全代谢为CO₂和H₂O,无长期积累风险。
四、药物递送机制与粒径效应
粒径依赖性行为
<10 μm:易被单核吞噬细胞系统(MPS)识别,靶向肝、脾等网状内皮系统,适用于富集递送。
10-200 μm:通过EPR效应(增强渗透与滞留)被动靶向特定组织,或经表面修饰后实现主动靶向(如连接叶酸受体抗体)。
>200 μm:机械刺激引发异物反应,激活NF-κB通路导致特定因子(TNF-α、IL-6)分泌。
释放动力学模型
Fick扩散模型:适用于小分子药物(如多柔比星)的扩散释放,释放速率与PLGA玻璃化转变温度(Tg)相关,Tg降低可加速药物扩散。
表面侵蚀模型:高GA含量PLGA微球通过水解降解表层,同步释放负载的蛋白质,维持药物活性。
溶胀-扩散协同模型:接枝亲水性聚合物后,微球先溶胀形成水通道,再通过扩散释放药物,适用于大分子(如mRNA)的递送。
五、应用方向
药物递送:
缓释/控释:PLGA微球可实现药物数天至数月的持续释放,减少给药频率。
靶向递送:表面修饰靶向配体(如抗体、多肽),可实现特定部位的特异性富集。
组织工程:
细胞载体:PLGA微球可负载生长因子(如BMP-2)或干细胞,促进骨、软骨再生。
支架材料:PLGA微球与胶原蛋白、羟基磷灰石复合,制备多孔支架,用于骨、软骨修复。
生物成像:
荧光标记:将荧光染料(如FITC、Cy5)共价结合至PLGA,制备荧光微球,用于细胞追踪或组织成像。
磁共振成像(MRI):负载超顺磁性氧化铁纳米颗粒(SPIONs)的PLGA微球可作为MRI造影剂,增强显影。

 2025-04-29 作者:wff 来源:
2025-04-29 作者:wff 来源:

