HA-N3(叠氮功能化透明质酸)与细胞膜受体的相互作用,是其实现靶向递送与生物调控的核心机制,主要依赖透明质酸(HA)骨架与细胞表面受体的特异性识别,叠氮基团的修饰则为后续功能化提供反应位点。
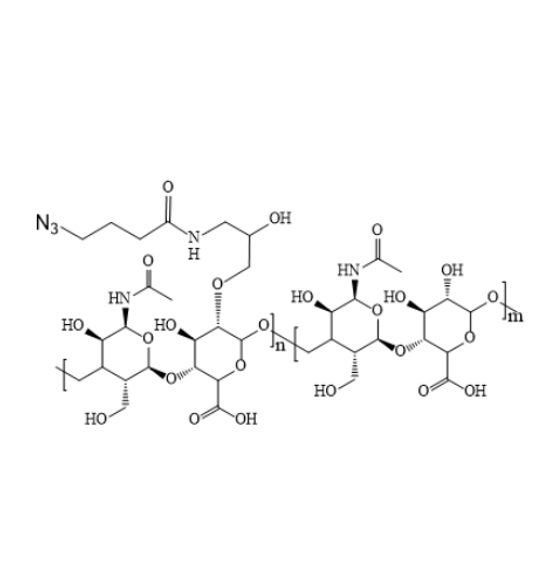
图为:HA-N3结构式
CD44 受体是 HA-N3 的主要结合靶点。HA 链中的重复二糖单元可与 CD44 的胞外结构域准确匹配,通过氢键与疏水作用形成稳定复合物。实验显示,HA-N3 与 CD44 的解离常数(Kd)约为 10⁻⁸-10⁻⁷ M,与天然 HA 的亲和力接近,证明叠氮修饰未破坏其受体结合能力。这种结合具有饱和性,当 HA-N3 浓度超过 1 μM 时,CD44 受体结合位点达到饱和,进一步增加浓度不会提升结合量。
RHAMM(透明质酸介导的运动受体)是另一重要作用靶点。与 CD44 不同,RHAMM 对 HA-N3 的识别更依赖分子量,低分子量 HA-N3(<50 kDa)与 RHAMM 的结合效率是高分子量的 2-3 倍,因其更易嵌入 RHAMM 的柔性结合口袋。结合后可激活下游信号通路,如 PI3K/Akt,促进细胞迁移与增殖。
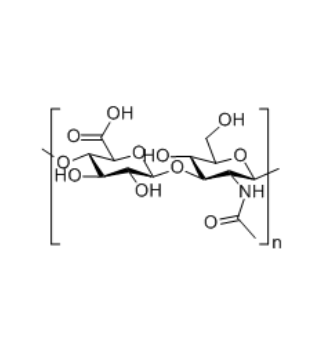
图为:透明质酸结构式
相互作用后会引发内吞效应。HA-N3 与受体结合后,通过网格蛋白介导的内吞途径进入细胞,形成早期内体。在酸性内体环境(pH5.0-6.0)中,HA 链发生部分降解,释放出携带的功能分子(如通过点击化学偶联的药物或探针)。这一过程在tumor细胞中更为活跃,因其高表达 CD44 与 RHAMM,使 HA-N3 的内吞量是正常细胞的 4-6 倍。
此外,离子强度影响结合稳定性,生理浓度的钙离子(1-2 mM)可增强 HA-N3 与 CD44 的相互作用,而高浓度钠离子会削弱结合力。该机制为 HA-N3 在靶向Treatment 中的应用提供依据,通过受体介导的主动靶向,提升药物在病变部位的富集效率。

 2025-07-22 作者:lkr 来源:
2025-07-22 作者:lkr 来源:

