Glucose-PEG-PLA 是由葡萄糖、聚乙二醇(PEG)和聚乳酸(PLA)构成的三嵌段共聚物,其结构特性对纳米颗粒制剂的稳定性具有多维度调控作用。
在物理稳定性方面,PEG 链的亲水性是关键。当 Glucose-PEG-PLA 修饰于纳米颗粒表面时,PEG 链向水相伸展形成 “水化层”,通过空间位阻效应阻碍颗粒间的聚集,同时降低界面张力,减少沉降风险。实验显示,经其修饰的 PLA 纳米粒在 4℃储存 3 个月后,粒径变化率<5%,远低于未修饰组的 20%。此外,葡萄糖基团的极性可增强颗粒表面的电荷斥力,尤其在生理盐浓度下,能维持颗粒分散性,避免盐诱导的絮凝。
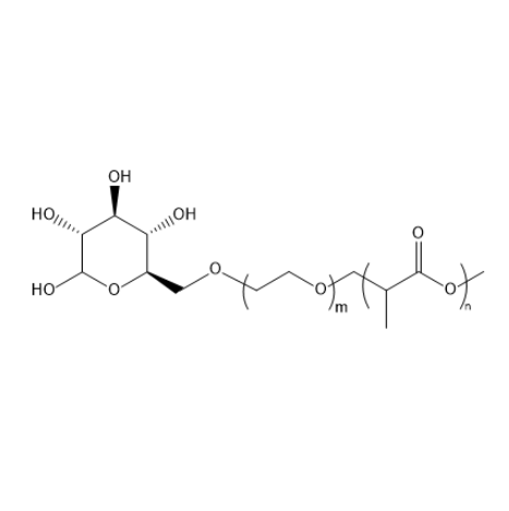
图为:Glucose-PEG-PLA结构式
化学稳定性上,PLA 段的疏水性与 PEG 的屏障作用协同保护包载药物。对于易氧化或水解的药物(如维生素 C、紫杉醇),Glucose-PEG-PLA 形成的核壳结构可隔绝外界氧气与水分子,减缓药物降解。数据表明,负载紫杉醇的纳米颗粒经修饰后,60 天内药物保留率提升至 85%,而未修饰组仅为 52%。
环境因素适配性是另一优势。在 pH 波动(pH 5.0-8.0)条件下,葡萄糖的多羟基可缓冲局部酸碱变化,减少 PLA 的降解速率,维持颗粒形态完整。高温(37℃)环境中,PEG 链的柔韧性抑制颗粒热运动加剧导致的融合,使纳米制剂在模拟体内环境下的稳定性延长 2-3 倍。
图为:葡萄糖结构式
不过,修饰比例需准确调控。当 Glucose-PEG-PLA 含量过低(<5%),难以形成有效水化层;过高(>20%)则可能因空间位阻过大导致颗粒结构松散,释放速率异常。研究证实,10%-15% 的修饰比例可实现稳定性与载药效率的最佳平衡。
综上,Glucose-PEG-PLA 通过空间位阻、电荷调节及屏障保护,全面提升纳米颗粒制剂的物理与化学稳定性,为其在长效药物递送中的应用提供了关键支撑。

 2025-07-16 作者:lkr 来源:
2025-07-16 作者:lkr 来源:

